Интерферон для грудничков — Груднички(дети)
Интерферон инструкция для грудничков
В современном мире плохая экология, стрессы, неправильный образ жизни часто приводят к рождению детей со слабым иммунитетом. Детям до года часто назначают интерферон для укрепления организма, и увеличению способности детского организма противостоять различным вирусным заболеваниям.
Интерферон защищает малышей, как противовирусное; улучшает общее состояние иммунитета, как иммуномодулятор, а также противодействует развитию опухоли, как противоопухолевое средство.
Препарат используют как в целях профилактики, так и для лечения начальных стадий вирусных болезней (грипп, ОРВИ и прочих) и для более тяжелых стадий заболеваний.
Суть действия интерферона заключается в помощи в продуцировании белков-интерферонов, необходимых организму для сопротивления вирусам. В детском возрасте эти белки вырабатываются с большим трудом, а зимой еще хуже. Вот почему препарат популярен среди врачей, педиатры часто назначают его для профилактики во время эпидемий и лечения.
Существует несколько лекарственных форм интерферона: мазь, ампулы с порошком, свечи.
Для совсем маленьких и недоношенных малышей назначают свечи (150000 МЕ). Принимать их требуется 2 раза в сутки с промежутками 12 часов в течение 5 дней. Обычно для полного излечения ОРВИ хватает одного курса.
Мазью в целях профилактики нужно смазывать нос 2 раза в сутки с промежутками 12 часов. Для лечения мазь используют по 0,5 г два раза в сутки в течение 2 недель. А последующие 2-4 недели мазь нужно применять реже – 3 раза в неделю.
Против стоматита, при лечении воспаления миндалин мазь также эффективна.
К побочным действиям интерферона относят: повышение температуры, озноб, мигрень, головокружение, одышка, судороги, учащенное сердцебиение, бессонница, тошнота, изменение характера стула, аллергия.
Длительное использование препарата грудничками не рекомендовано, так как наступает привыкание и, соответственно, ожидаемый эффект не наступает.
Интерферон противопоказан при наличии у ребенка различных заболеваний сердца и центральной нервной системы, печени, почек и индивидуальной непереносимостью компонентов.
Назначать самостоятельно препарат не следует, только опытный специалист учтет все возможные осложнения.
Интерферон для грудничков капли
Наиболее оптимальным вариантом приема интерферона для детей являются капли. При парентеральном (в нос) использовании вещества не проникают в желудочно-кишечный тракт.
Интерферон для закапывания в нос продается в ампулах, которые следует развести водой и немедленно использовать по назначению. Раствор готовится из 2 мл воды и содержимого одной ампулы.
Если препарат используется с целью профилактики, то разовая доза будет составлять по 5 капель в каждый носовой проход с промежутками в 6 часов. Процедуры следует продолжать в течение всего периода, когда есть риск заболеть. Однако не стоит переусердствовать и принимать препарат только при действительно серьезной угрозе.
В ситуации, когда грудничок уже заболел, промежутки между процедурами следует уменьшить до 2-х часов. Прием препарата продолжается 3 дня.
С помощью содержимого ампул можно приготовить раствор для ингаляций.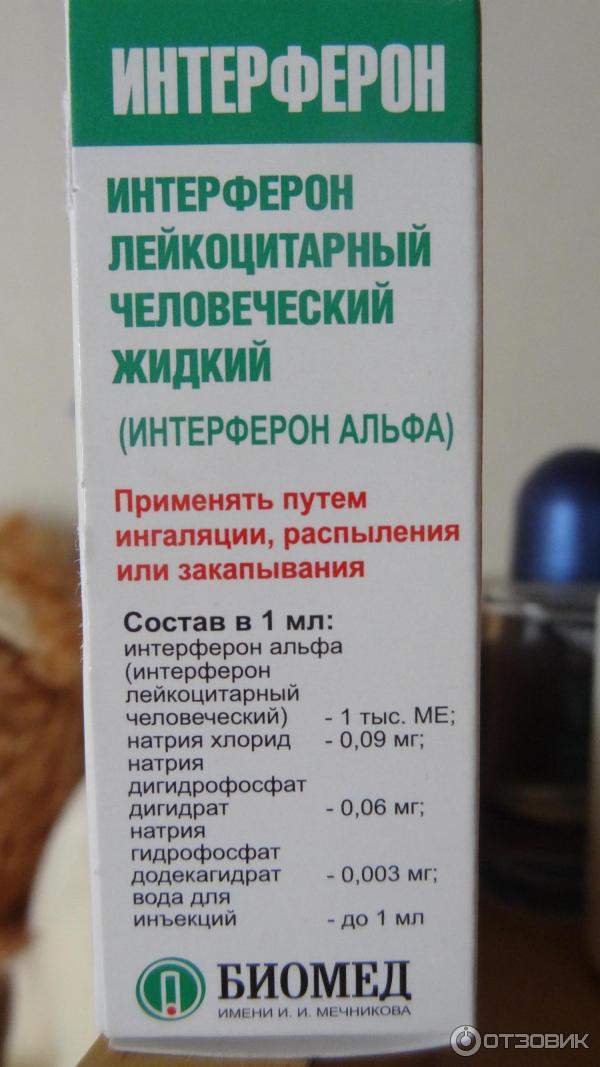 Такой способ приема лекарства считается наиболее эффективным. Раствор готовится из 10 мл теплой воды (около 37°С) и содержимого 3-х ампул. Далее использовать получившееся лекарство как при обычной ингаляции. Такая форма приема не рекомендуется более 2-х раз в сутки и с промежутками не менее 1-2 часов.
Такой способ приема лекарства считается наиболее эффективным. Раствор готовится из 10 мл теплой воды (около 37°С) и содержимого 3-х ампул. Далее использовать получившееся лекарство как при обычной ингаляции. Такая форма приема не рекомендуется более 2-х раз в сутки и с промежутками не менее 1-2 часов.
При офтальмологических заболеваниях, вызванных вирусом, раствор интерферона можно закапывать в глаза.
Интерферон для грудничков цена
Регион продажи, производитель, место продажи, лекарственная форма, объем лекарства, и прочие факторы сильно влияют на цену интерферона. В настоящее время в аптеках цена колеблется от 23,3 до 140,04 гривен.
Интерферон для грудничков отзывы
+ Ермакова Лиана
Здравствуйте! Я с маленьким ребенком 1 мес. лежала в больнице, лечили анемию. И как раз лечение совпало с эпидемией гриппа. Это же просто ужасно, в стационаре было так много больных детей, кто чихал, кто кашлял, а у кого просто температура. Я ужасно переживала, что Максимка тоже заразится. Наш лечащий врач посоветовал купить интерферон в свечах, так удобнее давать новорожденным. Купила, ставила по 1 свече в сутки в одно и то же время, пока не выписались. Слава богу, не заболели тогда, и дома в ту эпидемию никаких проблем не было. Хороший препарат, советую всем.
Наш лечащий врач посоветовал купить интерферон в свечах, так удобнее давать новорожденным. Купила, ставила по 1 свече в сутки в одно и то же время, пока не выписались. Слава богу, не заболели тогда, и дома в ту эпидемию никаких проблем не было. Хороший препарат, советую всем.
+ Зайка
У грудничка сестры поднялась температура 38, вызвали скорую помощь. Назначили несколько видов лекарств, среди них капли интерферон в течение 5 дней. Было подозрение на зубы и на ОРВИ. Думаю, что и в том и в другом случае поддержать иммунитет не будет лишним. А температура через сутки прошла и не поднималась больше.
Интерферон для грудничков (видео)
Хотя видео вроде бы и называется «Интерферон для грудничков», но в нем Вы не найдете ничего конкретного для своих малышей. В нем показывается действие интерферона (в мультяшной форме) и способ приготовления назального спрея из интерферона в домашних условиях.
Этот метод совершенно не подходит для грудных детей, т. к., во первых, грудничкам разводят препарат дистиллированной водой, во-вторых, применяют интерферон исключительно перорально, т.е. через ротовую полость.
к., во первых, грудничкам разводят препарат дистиллированной водой, во-вторых, применяют интерферон исключительно перорально, т.е. через ротовую полость.
Похожие инструкции:
Креон для грудничков
Микролакс для новорожденных
Проторголовые капли для грудничков
Цефекон свечи: инструкция, цена, отзывы
Виферон грудничкам
Интерферон для грудничков: инструкция, как давать
Каждой маме хочется, чтобы ее малыш не болел и легко переносил те недуги, уберечься от которых невозможно. Фармакологического средства, защищающего от всех инфекций, не существует. Но природа создала вещество, обладающее уникальными иммуностимулирующими свойствами, – интерферон. Ученые сумели воспроизвести его искусственным путем, и сегодня он выпускается в разных формах. В педиатрической практике чаще всего используется интерферон в виде порошка. Рассмотрим инструкцию по его применению для лечения детей младше года.
Общая информация об интерфероне
Интерферон – белок, синтезируемый практически всеми клетками организма человека. Он имеет три разновидности: α и β – обладают противовирусной активностью, γ – участвует в большинстве иммунных реакций.
Основные функции интерферона:
- стимулирование выработки веществ, подавляющих рост вирусов
- изменение структуры клеток для создания условий, непригодных для жизни инфекционных агентов
- остановка размножения микробов
Интерферон не борется с вирусами напрямую, но он мобилизует остальные клетки, предупреждая их об опасности и заставляя работать в режиме обороны. В результате возбудители заболевания либо не успевают запустить патологический процесс, либо наносят минимальный вред.
Что же заставляет клетки синтезировать интерферон? Прежде всего сам факт проникновения вируса. Но далеко не все микробы влияют на организм подобным образом. Некоторые из них, например, ВИЧ, гепатит С и В, аденовирус, вирус Эпстайна-Барр и некоторые другие, слабо стимулируют образование интерферона.
Помочь иммунной системе можно с помощью искусственного введения этого белка. Для этого разработано множество лекарственных препаратов.
Натуральное или рекомбинантное средство?
Все медикаменты с интерфероном делятся на две группы:
- Натуральные, получаемые из лейкоцитов человеческой крови, – «Интерлок», «Интерферон лейкоцитарный человеческий», «Лейкинферон».
- Искусственные (рекомбинантные), синтезируемые с помощью генно-инженерных технологий, – «Виферон», «Интераль», «Лаферобион».
Для лечения новорожденных и младенцев более безопасным считается применение рекомбинантных, а не натуральных средств. Они обладают одним существенным недостатком – присутствует минимальный риск заражения инфекцией от донора, из крови которого произведено лекарство.
Рекомбинантные интерфероны представлены в форме свечей, мазей, капель и порошков в ампулах. Последний вариант очень удобен. Разберемся, как его использовать, изучив информацию, которую содержит инструкция поприменению лекарства «Лаферобион».
Показания
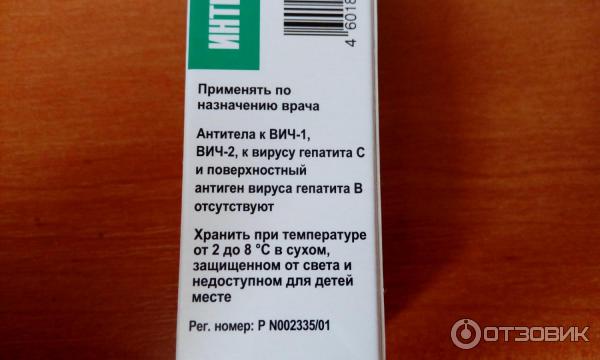
«Лаферобион» – лиофилизат (сухой порошок) для приготовления назального раствора, состоящий из рекомбинатного α-2b интерферона. Концентрация действующего вещества в 1 флаконе – 100 тысяч МЕ. Хранить его необходимо в холодильнике.
Препарат обладает противовирусной, иммуномодулирующей и противоопухолевой активностью. Инструкция приводит такие показания к применению:
- вирус герпеса
- вирус гепатита В
- раковые опухоли
- ОРВИ и вирусно-бактериальные патологии, в том числе у новорожденных детей
В младенческом возрасте капли с интерфероном чаще всего используются в составе комплексной терапии респираторных заболеваний, а также для их профилактики при реальной угрозе инфицирования (контакт с носителем вируса, периоды эпидемий).
Препарат под названием «Интерферон лейкоцитарный человеческий сухой» имеет такую же концентрацию активных веществ и аналогичные принципы применения. Единственное его отличие от «Лаферобиона» – производство из лейкоцитов крови.
Особенности применения
Начинать использование интерферона необходимо при первых симптомах ОРВИ либо сразу же после общения с больным человеком. Из сухого порошка следует приготовить раствор (капли) – залить в ампулу 2 мл дистиллированной или кипяченой (охлажденной) воды и взболтать. Хранить раствор можно не более 12 часов в холодильнике.
Инструкция предполагает два основных способа введения препарата:
- Закапывание в нос. Осуществляется для терапии и предупреждения респираторных заболеваний. Важно именно капать раствор, а не распылять. Использование спреев для носа при уходе за малышом до года может привести к попаданию слизи в евстахиеву трубу.
Новорожденных удобнее всего лечить путем поочередного введения смоченных в лекарстве турунд (2-3 капли на 1 жгутик) в носовые ходы. Вату необходимо оставлять на 10-15 минут. Повторять процедуру следует 4-6 раз в день. Малышам постарше средство можно закапывать в нос – по 5 капель в каждый ход с интервалом в 2 часа, но не более 6 раз в сутки.
При использовании интерферона в профилактических целях дозировка такая же, но частота введения меньше – 2 раза в сутки с перерывом минимум 6 часов.
- Ингаляции. Раствор делается из 3 флаконов порошка и 5 мл кипяченой или стерильной воды. Процедуру следует проводить 2 раза в сутки. Желательно использовать ультразвуковой, а не паровой ингалятор, чтобы исключить риск ожога горячим воздухом.Кроме того, капли можно вводить в конъюнктивальные мешки при вирусном воспалении слизистых оболочек глаз – по 2-3 капли каждые 2 часа в первые дни болезни.
Срок лечения интерфероном при ОРВИ – до выздоровления, но минимум 2-3 дня. Продолжительность профилактики – 7-10 дней.
Противопоказания и побочные действия
Капли с интерфероном противопоказаны к применению при его непереносимости, а также в случае тяжелых заболеваний почек, печени, сердца, ЦНС и щитовидной железы. Побочные эффекты при введении через нос или ингаляциях возникают редко, но иногда отмечаются:
- гриппоподобный синдром – боли в мышцах, озноб, гипертермия
- тошнота, диарея
- сонливость
- кожная сыпь
Вероятность негативных реакций повышается при длительном использовании лекарства и увеличении его доз.
Инструкция по применению предупреждает, что интерферон не следует использовать одновременно со стероидными гормонами и сосудосуживающими каплями для носа.
Отзывы
Мамы, использовавшие раствор интерферона для лечения своих детей, оставляют о лекарстве неоднозначные отзывы. Одни указывают на его действенность, отмечая, что закапывание сразу же после появления насморка позволяет избавиться от него за 3 дня. Периодические ингаляции или введение раствора в нос для профилактики дает возможность без проблем посещать детские коллективы в период активизации вирусных инфекций.
Прочитав отзывы других родителей, можно сделать вывод о невысокой эффективности интерферона в качестве терапевтического и превентивного средства. Кроме того, встречаются упоминания о возникновении аллергической сыпи после закапывания.
Мнение Е.О. Комаровского
Известный детский врач Е.О. Комаровский считает, что применять интерферон для лечения младенцев можно только по строгим медицинским показаниям: если иммунная система очень ослаблена или наблюдается тяжелая форма болезни.
При простой респираторной инфекции, сопровождающейся насморком и кашлем, необходимости в искусственном белке нет. Организм сам его вырабатывает: чем выше температура тела, тем активнее идет синтез. Такие заболевания проходят сами по себе за 5-7 дней. Главное – обеспечить ребенку нормальные условия воздуха и правильно за ним ухаживать.
Комаровский указывает на то, что сильнодействующий интерферон выпускается в виде растворов для инъекций и вводится только под врачебным контролем из-за внушительного списка побочных эффектов. Разнообразные капли, мази и свечи, продающиеся в аптеках без рецептов, и широко применяемые в качестве самолечения относятся к лекарствам с недоказанной эффективностью. То есть убедиться в том, что именно они помогли ребенку справиться с болезнью невозможно.
Интерферон – вещество с высокой противовирусной активностью, которое вырабатывается клетками организма человека. Его дополнительное введение оправдано в случае тяжелых заболеваний – гепатита, ВИЧа и прочих. Профилактическое и терапевтическое использование интерферона у грудничков при ОРВИ рекомендуется многими врачами. Но целесообразность этой меры, по мнению доктора Комаровского, сомнительна. Тем не менее, отзывы говорят о том, что закапывание лекарства в нос при первых признаках ринита во многих случаях предупреждало развитие затяжного заболевания. Применять капли или нет – индивидуальное решение педиатра и родителей ребенка.
Профилактическое и терапевтическое использование интерферона у грудничков при ОРВИ рекомендуется многими врачами. Но целесообразность этой меры, по мнению доктора Комаровского, сомнительна. Тем не менее, отзывы говорят о том, что закапывание лекарства в нос при первых признаках ринита во многих случаях предупреждало развитие затяжного заболевания. Применять капли или нет – индивидуальное решение педиатра и родителей ребенка.
Читайте также:
Интерферон для новорожденных – инструкция к применению
То и дело на слух попадаются радостные вести от близких друзей и старых знакомых о пополнении их семейства. Люди встречаются, влюбляются, женятся – как из старой песни. И уже полностью меняются мнения, стереотипы и желания. Теперь счастье – это когда на свет появляются беззащитные, и так похожие на нас малыши. Но вместе с радостью приходят первые трудности. Не все родители имеют за плечами богатый опыт по уходу за ребенком, а для кого-то радости материнства и вовсе ощущаются впервые.
Когда ребенку плохо…
Всем известны эти истории о бессонных ночах, и нескончаемом детском плаче, который не рассказывает и не объясняет желаний и потребностей. Родителям всегда мучительно смотреть на рыдающего младенца, порой они паникуют, не зная, какое лекарство давать, что и как лечить.
Несомненно, детишки болеют часто, и причин тому много: наследственность, плохая экология, слабый иммунитет.
Чадо может заболеть даже у самых ответственных родителей, что обязывает обращаться только к квалифицированным специалистам. Особенно когда речь идет о грудничках. У детских врачей большой популярностью стал пользоваться медицинский продукт под названием интерферон.
Его педиатры с завидной частотой назначают как профилактическое средство для взрослых, терапевтическое – для маленьких детей. Данная статья расскажет, что это такое, а, главное, чем же полезен хваленый продукт.
Основные сведения
Итак, медикамент относится к группе лекарственных средств противовирусного и иммуномодулирующего действия. Для полного понимания нужно разъяснить, что это, по сути, белок, который самостоятельно вырабатывается человеческим организмом, и отлично справляется с различными инфекциями. Интерферон препятствует размножению вирусов на всех этапах развития заболевания, он универсален и применим по отношению к практически любой вирусной инфекции.
Для полного понимания нужно разъяснить, что это, по сути, белок, который самостоятельно вырабатывается человеческим организмом, и отлично справляется с различными инфекциями. Интерферон препятствует размножению вирусов на всех этапах развития заболевания, он универсален и применим по отношению к практически любой вирусной инфекции.
Работа его состоит в том, чтобы помогать организму вырабатывать те самые белки, которые
необходимы нам для борьбы с вирусами.
К сожалению, детский организм способен вырабатывать недостаточное количество этого элемента, особенно зимней порой, когда вероятность подорвать иммунитет особенно велика.
Поэтому данный продукт назначают, как при первых симптомах вирусных заболеваний, таких как ОРВИ или грипп, так и на тяжелых стадиях болезни. Для профилактики он хорош именно тем, что начать его использование можно на любой стадии заболевания.
В настоящее время медикамент является основным лекарственным средством, применяемым не только педиатрами, но и офтальмологами, отоларингологами, неврологами, и даже онкологами. Последние активно практикуют его в борьбе с развитием и ростом опухолевых клеток.
Последние активно практикуют его в борьбе с развитием и ростом опухолевых клеток.
Правила применения
В аптеках вы можете приобрести интерферон в различных лекарственных формах. Он выпускается в виде мазей, свечей, а также ампулок с порошком. Для самых юных, в том числе недоношенных новорожденных, рекомендуется использовать свечи. Но капли интерферон остаются для грудничков самым приемлемым вариантом. Они не приносят болезненных или неприятных ощущений, да и ввести препарат ректально сможет не каждый родитель, что говорит о комфорте применения жидкой формы лекарства.
Теперь давайте разберемся с тем, как правильно капать интерферон в нос грудничку:
- Препарат следует капать именно в нос ребенка, потому что только так его действующие компоненты
не попадают в пищеварительную систему; - Для того чтобы подготовить капли в нос, вам изначально нужно приобрести порошок в ампулах;
- Порошок разводится в воде из расчета одна ампула на 2 мл воды, и тут же применяется по назначению.
 Разобраться во всех нюансах приготовления и хранения снадобья вам всегда поможет инструкция по применению, находящаяся в упаковке.
Разобраться во всех нюансах приготовления и хранения снадобья вам всегда поможет инструкция по применению, находящаяся в упаковке.
Как же использовать препарат в целях профилактики, чтобы укрепить иммунитет малыша? Ведь гораздо проще позаботиться о здоровье своего чада заранее, особенно если кто-то из домочадцев уже начал шмыгать носом или покашливать.
В данном случае поступаем следующим образом:
- Нужно тут же принять все возможные предупредительные меры. Для начала будет достаточно оградить ребенка от контактов с носителями вируса, и поскорее начать профилактику;
- Во время периода, когда вероятность заболеть становится критической, следует проводить нехитрые процедуры. А именно с периодичностью каждые 6 часов капать в оба носовых прохода ребенка по пять капель готового средства;
- Лекарство следует капать аккуратно, чтобы не повредить грудничку нос неосторожными действиями, не вызвать кашель или даже рвотный рефлекс;
- Если же ваш новорожденный все-таки заболел, капли в нос следует капать чаще, каждые два часа в течение трех дней.

Кстати, раствор можно закапывать не только в нос, но также в глазки, особенно в тех случаях, когда вирусы вызвали офтальмологическое заболевание. Однако надо помнить, усердствовать с лекарством не стоит. Применение любого средства необходимо лишь при возникновении действительно опасной угрозы, так как все знают, что лучше иногда вовсе обойтись без лекарств, чтобы организм, по возможности, боролся самостоятельно.
Побочные эффекты
Нас всех, конечно же, интересует, какие негативные последствия могут возникнуть от того, как мы лечим своих детишек. Беречь здоровье нужно смолоду, как и знать, чем грозит любое лекарственное средство.
Каждый родитель должен внимательно отнестись к тому, что гласит инструкция. Особое значение необходимо придать пункту о побочных эффектах. Сразу хочется предупредить о возможном повышении температуры и объяснить, почему это происходит.
- Интерферон для грудничков мобилизует все возможные ресурсы человеческого организма для борьбы с вирусами, а длительность повышенной температуры, вызванной лекарством, как правило, гораздо короче, чем от инфекции.

- Еще один момент, о котором вы должны знать — это аллергическая реакция, ведь с каждым годом количество детей-аллергиков увеличивается. Так вот, сам белок не может являться первопричиной появления реакции, ибо является природным соединением, но может повлиять на её усиление. Это случается потому, что происходит стимуляция многих процессов в организме, и в их число входят те, которые участвуют в реакциях аллергических.
Следует предупредить врача, назначающего данное лекарство, о существующей аллергии, чтоб он
совместил терапию со средством против аллергии. Всегда следует помнить, что долгое лечение не рекомендовано грудничкам, у малышей может наступить привыкание, иначе растущий организм не научится сам справляться с вирусами, и ваши действия не дадут ожидаемых результатов.
Ну и, конечно же, каждый родитель должен понимать, что ни в коем случае нельзя заниматься самолечением, какие бы прекрасные советы ни давали нам наши бабушки или опытные подруги, даже если инструкция по применению препарата интерферона для грудничков кажется вам безобидной.
Как бы вам ни хотелось скорее помочь своему малышу, лишь специалист назначит правильное лечение, профессионально оценив состояние ребенка.
Материалы, размещённые на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остаётся исключительной прерогативой вашего лечащего врача.
Эффективность применения наружной формы интерферона при реабилитации часто болеющих детей | #08/12
Система интерферона осуществляет в организме полифункциональное действие в трех основных направлениях: антивирусном, антипролиферативном, иммуномодулирующем. Несовершенство функционирования системы интерферона может явиться причиной повышения чувствительности детей к инфекционным заболеваниям и усугубления тяжести их течения.
Исследования, посвященные становлению системы интерферона в онтогенезе, позволили выявить некоторые связанные с этим возрастные особенности [1]. У новорожденных детей, по сравнению с взрослыми донорами, отмечается значительное снижение способности лейкоцитов к продукции интерферона альфа (ИФН-альфа), а также интерферона гамма (ИФН-гамма). При этом чем меньше гестационный возраст новорожденного ребенка, тем в большей степени оказываются снижены эти показатели [2]. У недоношенных новорожденных концентрация эндогенного интерферона в сыворотке крови превышает таковую у доношенных, детей раннего возраста и взрослых. Циркулирующий интерферон рассматривается в настоящее время как «ранний» интерферон, который имеет физиологическую направленность, отражая состояние системы интерферона развивающегося плода [1].
У новорожденных детей, по сравнению с взрослыми донорами, отмечается значительное снижение способности лейкоцитов к продукции интерферона альфа (ИФН-альфа), а также интерферона гамма (ИФН-гамма). При этом чем меньше гестационный возраст новорожденного ребенка, тем в большей степени оказываются снижены эти показатели [2]. У недоношенных новорожденных концентрация эндогенного интерферона в сыворотке крови превышает таковую у доношенных, детей раннего возраста и взрослых. Циркулирующий интерферон рассматривается в настоящее время как «ранний» интерферон, который имеет физиологическую направленность, отражая состояние системы интерферона развивающегося плода [1].
Действие «раннего» интерферона направлено не столько на защиту, сколько на развитие и дифференцировку клеток плода. Установлена взаимосвязь снижения уровня продукции «раннего» интерферона и отклонений от нормы развития плода у беременных женщин [3]. Выявлено также, что патология анте- и перинатального периодов онтогенеза, приводящая к развитию перинатальной гипоксии, фетоплацентарной недостаточности, провоцирует развитие иммунологических нарушений в системе мать–плацента–плод и отклонения в становлении иммунной системы в постнатальном онтогенезе [4].
Задачей данного исследования явилась разработка методов реабилитации часто болеющих детей (ЧБД) с использованием мази Виферон® [5] и анализ их эффективности.
Часто болеющим ребенок считался, если он переносил в течение года 4 и более острых респираторных заболеваний (ОРЗ) или если его индекс резистентности (РИ) составлял 0,33 и выше [6] — отношение числа ОРЗ, перенесенных ребенком к числу месяцев наблюдений.
В работе использовались клинические методы, исследование интерферонового статуса (сывороточный, ИФН-альфа, ИФН-гамма), по методу, предложенному С. С. Григорян и соавт. (1988), изучение клеточного звена иммунитета. Для выделенных субпопуляций Т-лимфоцитов определялось количество кислой фосфатазы методом азосочетания, по Goldberg и Вагка (1978).
Препараты интерферонов характеризуются сочетанием противовирусной, антибактериальной и иммуномодулирующей активности. В последние годы генно-инженерным методом были получены препараты интерферонов нового поколения (Реаферон, Реальдирон, а также зарубежные — Интрон А, Роферон-А), что позволяет исключить использование в качестве сырья донорской крови.
Перечисленные свойства Виферона®, в частности интерфероно- и иммунокорригирующее действие, послужили основанием для его применения при реабилитации данной категории детей. В качестве лекарственной формы применялась мазь Виферон®, содержащая в 1 г 40 тыс. МЕ интерферона альфа-2.
Препарат использовался в трех основных направлениях: при проведении курсов иммуно- и интерферонореабилитации; в периоде адаптации к дошкольному учреждению; с профилактической целью в период подъема заболеваемости ОРВИ.
Мазь Виферон® вводилась интраназально по разработанному нами методу (патент РФ № 2214272 от 20.10.2003) 2 раза в день в суточной дозе 1 г [5]. Первые 2 нед препарат применялся ежедневно, последующие 2–4 нед — 3 раза в неделю.
Под наблюдением находились ЧБД, посещающие дошкольные учреждения и воспитывающиеся в доме ребенка. Возраст детей колебался от 3 мес до 5,5 лет. Из них более половины (61,6%) составляли дети раннего возраста. Все ЧБД имели отклонения в анте- и перинатальном периоде развития. Мазь Виферон® получили 73 ребенка (основная группа). Группу сравнения, в которой дети не получали препарат, а также другие иммуномодулирующие средства, составили 34 ребенка того же возраста, имеющие неблагоприятное течение раннего онтогенеза и страдающие частыми респираторными инфекциями. В обеих группах проводились общеоздоровительные мероприятия (массаж, витаминотерапия, лечебная физкультура и т. д.).
Мазь Виферон® получили 73 ребенка (основная группа). Группу сравнения, в которой дети не получали препарат, а также другие иммуномодулирующие средства, составили 34 ребенка того же возраста, имеющие неблагоприятное течение раннего онтогенеза и страдающие частыми респираторными инфекциями. В обеих группах проводились общеоздоровительные мероприятия (массаж, витаминотерапия, лечебная физкультура и т. д.).
Анализ клинической эффективности мазевой формы Виферона® показывает его выраженное влияние на заболеваемость детей в периоде адаптации к дошкольному учреждению. Среди детей, получавших виферонопрофилактику, 41% не заболели в первые 3,5 мес после поступления в дошкольное учреждение. В группе сравнения все наблюдавшиеся дети за этот период переболели. Число дней, пропущенных по болезни, в группе получавших Виферон® оказалась в 2,2 раза ниже, чем в группе сравнения (р < 0,01), а число эпизодов ОРЗ, перенесенных одним ребенком, — почти в 2 раза ниже (р < 0,01).
Одновременно с положительным клиническим эффектом отмечалось улучшение иммунологических показателей. Это выражалось в достоверном (р < 0,01) увеличении хелперной субпопуляции Т-лимфоцитов (38,2 ± 0,45% и 41,73 ± 0,67% соответственно), в уменьшении Т-супрессоров (22,98 ± 0,52% и 21,27 ± 0,62% соответственно, р < 0,05), в нормализации иммунорегуляторного индекса (1,68 ± 0,06 и 1,96 ± 0,09 соответственно, р < 0,01). Достоверных различий в динамике иммунологических показателей у детей группы сравнения за это же время не выявлено (р > 0,05). Последующие наблюдения в течение года показали, что влияние виферонопрофилактики, проведенной в периоде адаптации к дошкольному учреждению, на заболеваемость детей постепенно со временем уменьшается. Так, если заболеваемость детей за первые 3,5 мес после приема препарата была в 2 раза ниже, чем в группе сравнения, то за 6 мес она оказалась в 1,5 раза, а за 8 мес — в 1,4 раза ниже, чем в группе детей, не получавших препарат. Это обусловливает необходимость проведения повторных курсов виферонопрофилактики у ЧБД, поступивших в дошкольные учреждения, через каждые 3–4 мес до достижения стойкого клинического эффекта.
Это выражалось в достоверном (р < 0,01) увеличении хелперной субпопуляции Т-лимфоцитов (38,2 ± 0,45% и 41,73 ± 0,67% соответственно), в уменьшении Т-супрессоров (22,98 ± 0,52% и 21,27 ± 0,62% соответственно, р < 0,05), в нормализации иммунорегуляторного индекса (1,68 ± 0,06 и 1,96 ± 0,09 соответственно, р < 0,01). Достоверных различий в динамике иммунологических показателей у детей группы сравнения за это же время не выявлено (р > 0,05). Последующие наблюдения в течение года показали, что влияние виферонопрофилактики, проведенной в периоде адаптации к дошкольному учреждению, на заболеваемость детей постепенно со временем уменьшается. Так, если заболеваемость детей за первые 3,5 мес после приема препарата была в 2 раза ниже, чем в группе сравнения, то за 6 мес она оказалась в 1,5 раза, а за 8 мес — в 1,4 раза ниже, чем в группе детей, не получавших препарат. Это обусловливает необходимость проведения повторных курсов виферонопрофилактики у ЧБД, поступивших в дошкольные учреждения, через каждые 3–4 мес до достижения стойкого клинического эффекта.
Виферонопрофилактика, наряду со снижением заболеваемости, способствовала облегчению адаптации к дошкольному учреждению и за счет уменьшения эмоционально-поведенческих нарушений. Это связано с более длительным пребыванием детей в коллективе, возможностью осуществления психолого-педагогических воздействий.
Мазь Виферон® была включена также в комплекс реабилитации ЧБД, которая проводится обычно 2 раза в год. Клинические наблюдения, проведенные в течение года, показали, что виферонореабилитация приводит к снижению заболеваемости респираторными инфекциями в 2,0–1,7–2,1 раза. При этом наиболее выраженный эффект отмечается у детей раннего возраста.
Применение мази Виферон® способствует достоверному (р < 0,01) увеличению синтеза ИФН-гамма у ЧБД как первого года жизни, так и более старшего возраста. Отмечается достоверное снижение циркулирующего «раннего» интерферона у детей второго и третьего года жизни. Если до виферонореабилитации он определялся у 66,67% обследованных, то после ее окончания — у 28,27% ЧБД (р < 0,05).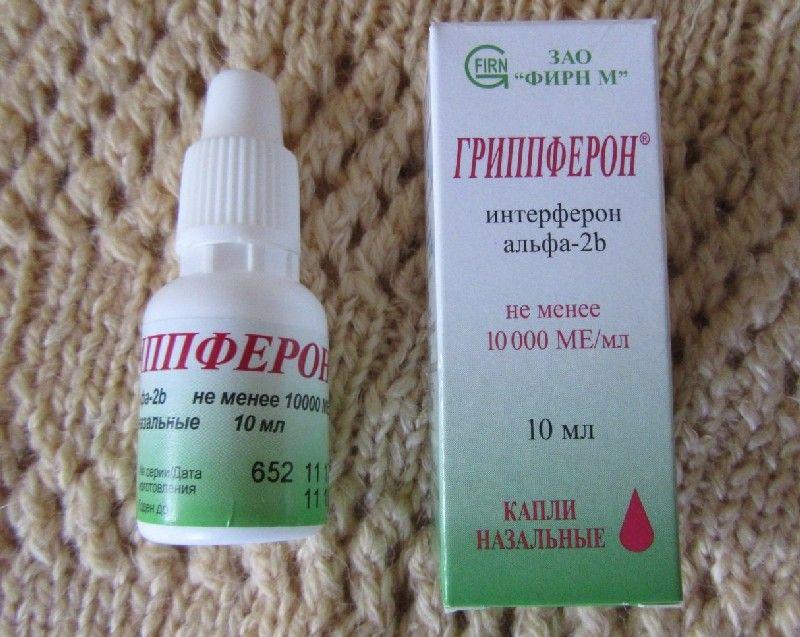 У ЧБД первого года жизни достоверного снижения циркулирующего «раннего» интерферона не происходит (р > 0,05). После курса виферонореабилитации циркуляция его сохраняется у подавляющего большинства (85,71%) детей, что указывает на необходимость более длительного применения препарата у детей данного возраста. Достоверного повышения способности к продукции ИФH-альфа не выявлялось у всех без исключения обследованных детей (р > 0,05). Можно утверждать, что параллельно с нарастанием синтеза ИФН-гамма после курса виферонореабилитации у ЧБД отмечается существенная положительная динамика показателей клеточного иммунитета; нарастает хелперная субпопуляция Т-лимфоцитов (р < 0,01), снижается число Т-супрессоров (р < 0,01), возрастает иммунорегуляторный индекс (р < 0,01). Достоверных изменений в изученных показателях клеточного иммунитета в группе детей, не получавших Виферон®, за это время не происходило (р > 0,05).
У ЧБД первого года жизни достоверного снижения циркулирующего «раннего» интерферона не происходит (р > 0,05). После курса виферонореабилитации циркуляция его сохраняется у подавляющего большинства (85,71%) детей, что указывает на необходимость более длительного применения препарата у детей данного возраста. Достоверного повышения способности к продукции ИФH-альфа не выявлялось у всех без исключения обследованных детей (р > 0,05). Можно утверждать, что параллельно с нарастанием синтеза ИФН-гамма после курса виферонореабилитации у ЧБД отмечается существенная положительная динамика показателей клеточного иммунитета; нарастает хелперная субпопуляция Т-лимфоцитов (р < 0,01), снижается число Т-супрессоров (р < 0,01), возрастает иммунорегуляторный индекс (р < 0,01). Достоверных изменений в изученных показателях клеточного иммунитета в группе детей, не получавших Виферон®, за это время не происходило (р > 0,05).
Таким образом, применение мази Виферон® с целью реабилитации нарушений в системе интерферона у ЧБД с дизонтогенетическими отклонениями в анамнезе оказывает существенное интерферонокорригирующее и иммуномодулирующее действие. Оно проявляется в стимуляции гамма-интерфероногенеза, уменьшении циркулирующего «раннего» интерферона, повышении хелперной активности клеточного звена иммунитета, нормализации соотношения субпопуляций Т-лимфоцитов. Клинически данный процесс коррелирует со снижением числа эпизодов респираторных инфекций, повышением резистентности детей, облегчением адаптационного синдрома в период привыкания к дошкольному учреждению.
Оно проявляется в стимуляции гамма-интерфероногенеза, уменьшении циркулирующего «раннего» интерферона, повышении хелперной активности клеточного звена иммунитета, нормализации соотношения субпопуляций Т-лимфоцитов. Клинически данный процесс коррелирует со снижением числа эпизодов респираторных инфекций, повышением резистентности детей, облегчением адаптационного синдрома в период привыкания к дошкольному учреждению.
Курс виферонопрофилактики проводился в весеннее время года с учетом выявленных и описанных нами ранее сезонных ритмов интерфероногенеза. Для сопоставления полученных данных анализировалась заболеваемость респираторными инфекциями за 2 мес до виферонопрофилактики и в течение 2 мес после ее окончания. Изучение клинической эффективности препарата показало ее различие у детей раннего и дошкольного возраста. У детей раннего возраста во время виферонопрофилактики не было случаев заболеваний. В течение последующих 2 мес по сравнению с тем же временным отрезком, предшествующим профилактике, отмечалось снижение заболеваемости ОРВИ в 4 раза по числу случаев и в 6,6 раза по числу дней, пропущенных одним ребенком (р < 0,01).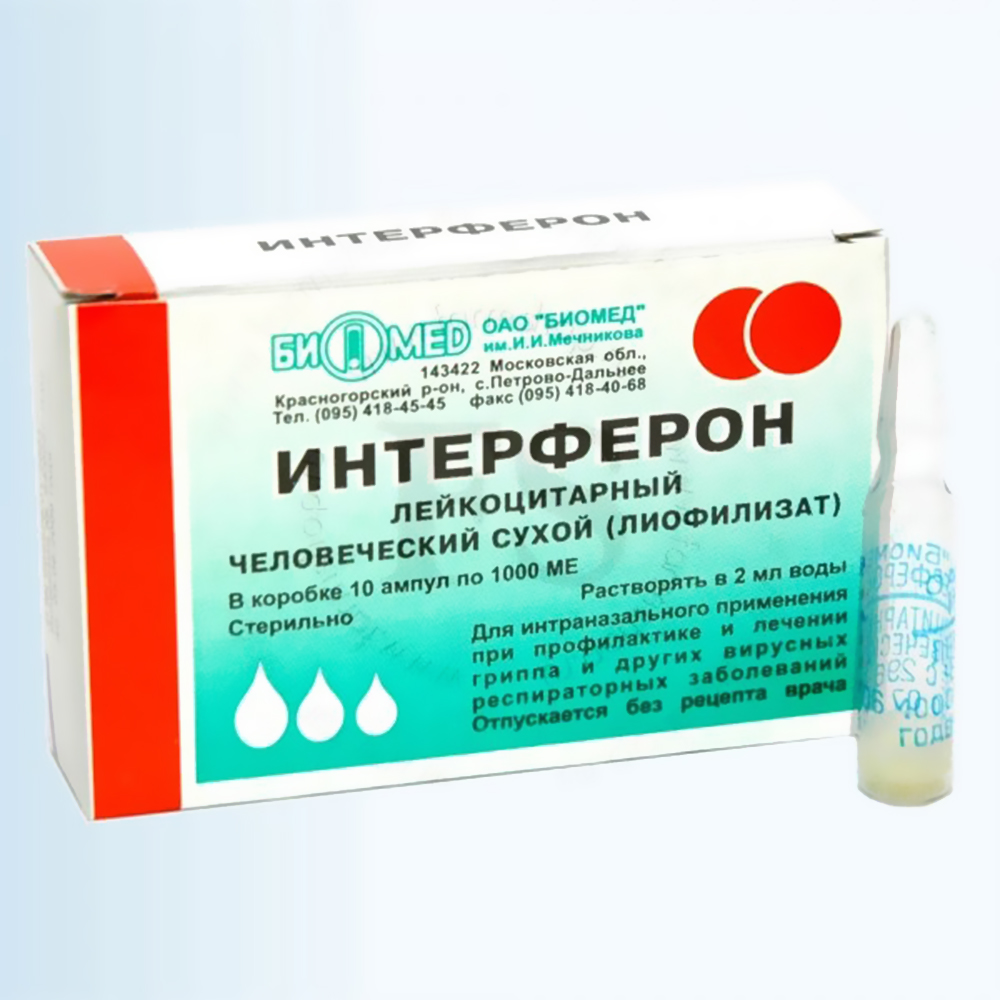 Достоверных различий в заболеваемости детей дошкольного возраста до и после проведения виферонопрофилактики не определялось.
Достоверных различий в заболеваемости детей дошкольного возраста до и после проведения виферонопрофилактики не определялось.
Более выраженная эффективность виферонопрофилактики у детей первых 3 лет жизни может быть обусловлена оптимально подобранной дозой препарата и схемой его введений, пластическими способностями организма детей раннего возраста, и в частности их иммунной системы, обусловливающими высокий иммуномодулирующий эффект.
Исследование интерферонового статуса детей до и после виферонопрофилактики показывает ее положительное влияние на состояние системы интерферона. У обследованных детей отмечается достоверное нарастание продукции ИФН-гамма (р < 0,01), уменьшение циркулирующего «раннего» интерферона (р < 0,01). Число детей, у которых выявляется «ранний» интерферон, уменьшается в 2,7 раза. В группе сравнения исследования, проведенные в те же сроки, достоверных изменений в показателях интерферонового статуса не выявили (р > 0,05).
Следует отметить отсутствие побочных эффектов, в том числе аллергических реакций, отрицательных изменений лабораторных показателей при применении мази Виферон® у всех наблюдавшихся детей.
Таким образом, использование мазевой формы отечественного препарата Виферон® у ЧБД оказывает интерферонокоррегирующее и иммуномодулирующее действие, способствуя нарастанию продукции ИФН-гамма, хелперной субпопуляции Т-лимфоцитов, уменьшению циркулирующего «раннего» интерферона, нормализации иммунорегуляторного индекса, снижению заболеваемости ОРВИ, облегчению адаптации в период привыкания к новым микросоциальным условиям.
Литература
- Ершов Ф. И., Киселев О. И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЕОТАР-Медиа, 2005. 368 с.
- Алферов В. П., Ариненко Р. Ю., Аникин В. Б., Малиновская В. В. Система интерферона и интерферонотерапия: новые возможности и перспективы // Российский семейный врач. 1998. № 1. С. 35–41.
- Макарова З. С., Доскин В. А., Малиновская В. В. Эффективность применения мази виферон при реабилитации часто болеющих детей // Лечащий Врач. 2006. № 1. С.
 86–87.
86–87. - Малиновская В. В. Новый отечественный комплексный препарат Виферон и его применение в перинатологии и и педиатрии при инфекционной патологии // Российский вестник перинатологии и педиатрии. 1999. № 3. С. 36–43.
- Малиновская В. В., Деленян Н. В., Ариненко Р. Ю., Мешкова Е. Н. Виферон: Рук-во для врачей. М., 2006. 56 с.
- Любимова О. И. Патогенетическое и клиническое значение различных вариантов иммунного ответа при бронхиальной астме у детей (обзор литературы) // Российский вестник перинатологии и педиатрии. 2001. № 1. С. 39–42.
- Нестерова И. В. Низко-, средне- и высокодозовая терапия рекомбинантным интерфероном α2b (вифероном) при вторичных иммунодефицитных состояниях, сопровождающихся синдромом упорно-рецидивирующей вирусной инфекции // Аллергология и иммунология. 2000. № 3. С. 70–79.
3. С. Макарова*, доктор медицинских наук, профессор
В.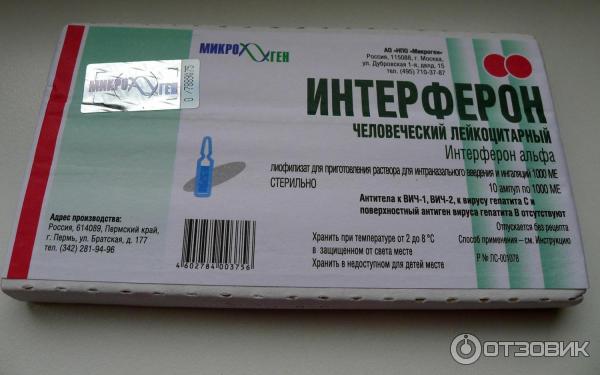 А. Доскин*, доктор медицинских наук, профессор
А. Доскин*, доктор медицинских наук, профессор
В. В. Малиновская**, доктор биологических наук, профессор
В. В. Парфенов**, кандидат медицинских наук
*ГБОУ ДПО РМАПО Минздравсоцразвития России,
**ФГБУ НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи Минздравсоцразвития России, Москва
Контактная информация об авторах для переписки: [email protected]
Минздрав не рекомендует интерферон-альфа для лечения детей с COVID-19 » Медвестник
Минздрав выпустил вторую версию рекомендаций по лечению COVID-19 у детей. Документ обновлен с учетом российского и зарубежного опыта, данных о течении инфекции и лекарственной терапии.
Минздравом утверждена вторая версия методических рекомендаций «Особенности клинических проявлений и лечения заболевания, вызванного новой коронавирусной инфекцией (COVID-19), у детей». Документ опубликован на сайте ведомства и направлен в регионы для использования в клинической практике.
Заболеваемость детей COVID-19
Среди пациентов с зарегистрированными случаями COVID-19 дети составляют 6–7%. Заболевание регистрируется и у новорожденных.
За весь период пандемии в мире зарегистрированы единичные смертельные исходы у детей.
Тяжелое течение COVID-19 у детей
Тяжелое течение отмечается в среднем в 1% случаев COVID-19 у детей. Осложненные формы развиваются у имеющих тяжелые сопутствующие заболевания.
Клинические формы у детей
Клинически выраженная инфекция у детей может протекать в легкой форме, в виде пневмонии без дыхательной недостаточности, острого респираторного дистресс-синдрома и мультисистемного воспалительного синдрома (МВС).
МВС протекает с симптоматикой неполного синдрома Кавасаки, гемофагоцитарного синдрома. МВС является аналогом тяжелого течения заболевания у взрослых – цитокинового шторма.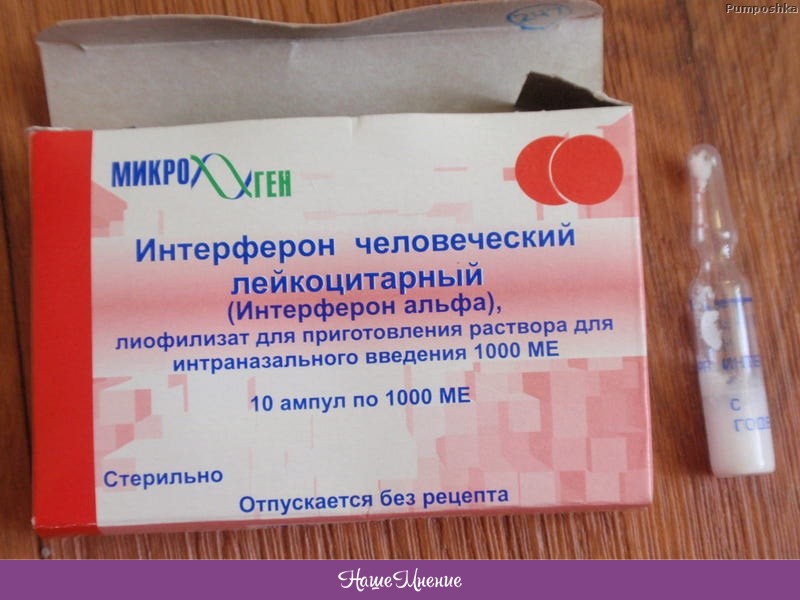 В мире описано около 600 случаев, 6 летальных исходов.
В мире описано около 600 случаев, 6 летальных исходов.
Инфекция у новорожденных
Не обнаружено вертикальной передачи инфекции от матери к ребенку. Все случаи считаются приобретенными после рождения.
Лечение COVID-19 у детей
- Противовирусная терапия рекомендована в тяжелых случаях, однако достоверные данные об эффективности у детей отсутствуют. Применение отдельных лекарственных препаратов допустимо по решению врачебной комиссии.
- Противовоспалительные, противомалярийные препараты для лечения COVID-19 у детей назначаются, если потенциальная польза превышает риск.
- Следует избегать применения аэрозолей.
- Данные об эффективности интраназального и ректального рекомбинантного интерферона-альфа отсутствуют. Клинические рекомендаций США и ВОЗ категорически не рекомендуют интерферон-альфа для лечения, тем более для профилактики.
- Лопинавир/ритонавир не рекомендован детям.

- Иммуноглобулин человеческий назначают детям с Кавасаки-подобным синдромом.
Плановая вакцинация
Плановые прививки проводятся здоровым и неконтактным детям.
инструкция по применению, аналоги, состав, показания
Детям с неонатального периода (с рождения) препарат применяется интраназально (путем распыления или закапывания). Для детей с 3-х лет и взрослых — дополнительно в виде ингаляции.
Интраназально
Ампулу с препаратом вскрывают непосредственно перед применением. Стерильную дистиллированную или охлажденную до комнатной температуры кипяченую воду добавляют в ампулу до черты, указанной на ампуле, соответствующей 2 мл, осторожно встряхивают до полного растворения содержимого. Растворенный препарат — прозрачная или слегка опалесцирующая жидкость, бесцветная или от светло-желтого до розового цвета. Растворенный препарат можно хранить при температуре от 2 до 8 °C в течение 1 сут.
Препарат применяют путем закапывания (с помощью медицинской пипетки или шприца без иглы) или распыления. Распыление производится распылителями любой системы или с помощью прилагаемой насадки-распылителя.
Для профилактики введение препарата следует начинать при непосредственной угрозе заражения и продолжать до тех пор, пока опасность заражения сохраняется. Препарат применяют интраназально путем закапывания по 5 капель или распыления по 0,25 мл в каждый носовой ход 2 раза в сутки с интервалом не менее 6 часов.
Для лечения препарат применяют на ранней стадии заболевания при появлении первых клинических симптомов интраназально по 0,25 мл (5 капель) в каждый носовой ход через 1-2 ч не менее 5 раз в сутки. Эффективность препарата тем выше, чем раньше начато его применение.
Правила применения насадки-распылителя:
Надеть иглу на шприц, наполнить его растворенным препаратом в объеме 0,25 мл (отметка 10 по шкале 40 ед. или отметка 25 по шкале 100 ед.). Снять иглу и плотно надеть насадку-распылитель. Поднести вплотную к носовому ходу насадку-распылитель и резким нажатием на поршень шприца впрыснуть препарат в носовой ход. Снять насадку-распылитель, надеть иглу и набрать в шприц 0,25 мл препарата из ампулы. Снять иглу, снова плотно надеть насадку-распылитель и ввести препарат в другой носовой ход в соответствии с пунктом 3.
или отметка 25 по шкале 100 ед.). Снять иглу и плотно надеть насадку-распылитель. Поднести вплотную к носовому ходу насадку-распылитель и резким нажатием на поршень шприца впрыснуть препарат в носовой ход. Снять насадку-распылитель, надеть иглу и набрать в шприц 0,25 мл препарата из ампулы. Снять иглу, снова плотно надеть насадку-распылитель и ввести препарат в другой носовой ход в соответствии с пунктом 3.Насадку-распылитель вводят на глубину 0,5 см в носовые ходы, предварительно очищенные от слизи. Пациент при этом должен находиться в сидячем положении со слегка запрокинутой головой и оставаться в этом положении в течение 1 минуты после введения препарата. Допускается использование одной насадки только у одного пациента.
Особые указания
Введение препарата путем инъекций категорически запрещается.
Применять с осторожностью лицам с аллергическими заболеваниями.
Применение в педиатрии
Детям с неонатального периода (с рождения) препарат применяется путем распыления и закапывания.
Применение в период беременности и лактации
Данных по опыту применения у беременных нет. Поэтому препарат применяют по назначению врача с учетом соотношения ожидаемой пользы для матери и возможного риска для плода и ребенка.
В период лактации ограничений по применению нет.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Не влияет.
Особенности влияния лекарственного средства у лиц с нарушением функции печени и почек и в геронтологической практике
Не выявлено особенностей применения лекарственного препарата у лиц с нарушением функции печени и почек. Не выявлено особенностей применения в геронтологической практике
В Москве прошел симпозиум с участием специалистов из Монголии, Казахстана и Узбекистана, посвященный одной из актуальнейших сегодня медицинских и социальных тем – роли интерферонов в лечении вирусных заболеваний. Сегодня эпидемиологическая обстановка в России и других развитых странах заставляет клиницистов разрабатывать все новые и новые подходы к лечению самых разнообразных вирусных инфекций. Так, доктор медицинских наук, профессор кафедры клинической иммунологии и аллергологии Сеченовского университета Олег Витальевич Калюжин в своем выступлении «ВИФЕРОН® в лечении гриппа и других ОРВИ» поднял серьезную проблему терапии гриппа и ОРВИ в условиях постоянно возникающих новых патогенов и высокой изменчивости известных штаммов. Он привел сравнительный анализ механизма работы существующих противовирусных средств и сделал важный вывод: интерфероны – центральное звено противовирусной защиты. Интерфероны альфа следует использовать именно как средства противовирусной терапии (виростатики) – то есть, в период активной репликации вируса для лечения или экстренной постконтактной профилактики респираторной вирусной инфекции. Доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней у детей педиатрического факультета РНИМУ им. Доклад «Роль препаратов интерферона-альфа в лечении вирусных диарей у детей» доктора медицинских наук, профессора, заведующей кафедрой детских инфекционных болезней ГОУ ДПО Российской медицинской академии последипломного образования Людмилы Николаевны Мазанковой был посвящен важной проблеме терапии ротавирусной инфекции.  И спектр применения препаратов интерферонового ряда продолжает расширяться. И спектр применения препаратов интерферонового ряда продолжает расширяться. |
Интерфероны типа I у новорожденных — нейротоксичность в сравнении с противовирусной защитой
КОММЕНТАРИЙ
Первичная инфекция вирусом простого герпеса 1 (HSV-1) в основном приводит к бессимптомным ответам хозяина. Если симптомы действительно возникают, они обычно ограничиваются тем, что обычно называют «герпесом». Однако в очень редких случаях ВПГ-1 может вызывать диссеминированное или специфическое заболевание головного мозга у детей и взрослых. ВПГ-1 имеет серологическую распространенность от 60 до 85% населения в большинстве стран мира, тогда как заболеваемость герпетическим энцефалитом (HSE) оценивается примерно в 1 на 1 000 000 человек.Был идентифицирован генетический вклад в развитие HSE у детей (не новорожденных) и взрослых после первичной инфекции, что показывает, что путь Toll-подобного рецептора 3 (TLR3) не является избыточным в контроле HSV-1, особенно в нейронах и олигодендроцитах. . HSE, как правило, носит спорадический, а не семейный характер, но мутации TLR3 , UNC93B1 , TRIF , TRAF3 , TBK1 и IRF3 были определены как причины HSE и вероятность развития HSE. считается примерно в 100 раз выше, чем в общей популяции для носителей сильно гипоморфных или нулевых аллелей TLR3 (1).Сообщалось о более широком инфекционном фенотипе, включая HSE, при дефиците человека, влияющем на путь интерферона типа I (IFN), у пациентов с мутациями зародышевой линии STAT1 и NEMO (1).
. HSE, как правило, носит спорадический, а не семейный характер, но мутации TLR3 , UNC93B1 , TRIF , TRAF3 , TBK1 и IRF3 были определены как причины HSE и вероятность развития HSE. считается примерно в 100 раз выше, чем в общей популяции для носителей сильно гипоморфных или нулевых аллелей TLR3 (1).Сообщалось о более широком инфекционном фенотипе, включая HSE, при дефиците человека, влияющем на путь интерферона типа I (IFN), у пациентов с мутациями зародышевой линии STAT1 и NEMO (1).
HSE имеет явно более высокую заболеваемость у новорожденных (в возрасте до 12 недель), чем у детей старшего возраста и взрослых. Большинство случаев HSE происходит в течение 6 недель после рождения. Считается, что в этой конкретной популяции инфекция приводит к развитию HSE в каждом третьем случае. Эта восприимчивость к инфекции снижается до уровня взрослых в течение нескольких недель, подчеркивая быстрые иммунологические изменения, происходящие у новорожденных.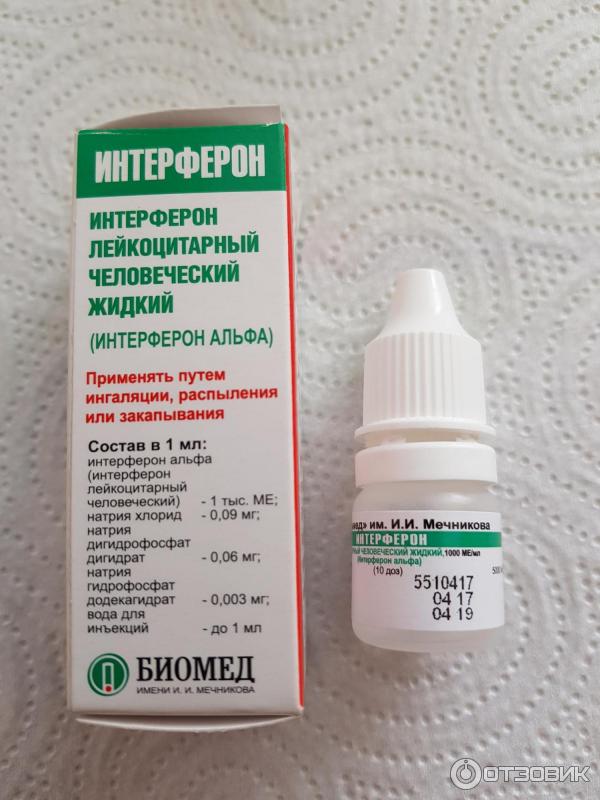 Точные физиологические доказательства разницы между первичной инфекцией HSV-1 у новорожденных и взрослых остаются неполными, хотя недавняя статья в mBio дает важные новые идеи (2).
Точные физиологические доказательства разницы между первичной инфекцией HSV-1 у новорожденных и взрослых остаются неполными, хотя недавняя статья в mBio дает важные новые идеи (2).
Причина восприимчивости к HSV-1 в первые 12 недель жизни, вероятно, не является генетической, учитывая, что у большинства инфицированных новорожденных наблюдаются тяжелые симптомы у двух третей, а у одной трети развивается HSE. Инфекция новорожденных HSV-1 связана с очень высокими уровнями заболеваемости и смертности, несмотря на лечение ацикловиром, который, по мнению некоторых, остается недостаточно используемым в этой популяции пациентов.В недавней статье в mBio Wilcox et al. (2) обратите внимание на важные различия между неонатальными и взрослыми инфекциями HSV-1. Авторы идентифицировали сосудистое сплетение у новорожденных мышей и в головном мозге посмертных новорожденных людей как анатомическое место надежной репликации HSV-1. Определяя уровни ряда эффекторов врожденного иммунитета в сосудистом сплетении у новорожденных и взрослых, они также идентифицировали значительно более низкие уровни рецептора IFN (IFNAR) в сосудистом сплетении новорожденных как причину восприимчивости к HSV-1, обеспечивая лучшее понимание патогенеза HSE у новорожденных.
Другой важный и даже более широкий вопрос, возникающий в связи с этими открытиями, — это эволюционное преимущество. Какую пользу приносит новорожденному более низкий уровень IFNAR, который может подвергнуть его риску смерти или пожизненных тяжелых неврологических последствий, если он инфицирован ВПГ-1 в первые 3 месяца жизни? Согласно бритве Оккама, самый простой ответ обычно правильный. Самый простой ответ здесь заключается в том, что уровни IFNAR во время внутриутробного развития и в первые 12 недель жизни, аналогичные уровням взрослых, более вредны для перинатального здоровья, чем вероятность заражения HSV-1.Появляется все больше свидетельств того, что этот простейший ответ действительно правильный.
Давайте рассмотрим две линии свидетельств генетики человека. Первый исходит от людей со слишком высокой активностью IFN во время перинатального развития, имитируя избыток IFNAR и его связывание с IFN. Интерферонопатии типа I — это расстройства, которые заметно характеризуются нарушением регуляции / персистенции сигнала IFN. Генетическое вскрытие определенного типа интерферонопатии I, синдрома Айкарди-Гутьера, первоначально описанного как прогрессирующее заболевание мозга с ранним началом, выявило мутации TREX1 , RNASEh3A , RNASEh3B , RNASEh3 C, 0005 SAM1 , ADAR и MDA5 как причинные . Выявлены другие генетические причины интерферонопатий I типа. Пациенты с мутациями ISG15 , USP18 , RIG-I , STING , PSMB8 и ACP5 также демонстрируют системные особенности нарушения регуляции IFN (3, 4). Тяжесть и время начала различаются у пациентов с вышеупомянутыми интерферонопатиями I типа, даже если они несут одни и те же мутации, но неврологические и аутовоспалительные симптомы с ранним началом особенно часто встречаются при всех интерферонопатиях I типа.По сути, эти природные эксперименты говорят нам, что слишком ранний прием IFN является нейротоксичным. Следовательно, есть эволюционное преимущество в том, чтобы приручить ответ на IFN во время развития в утробе матери и в очень раннем возрасте.
Генетическое вскрытие определенного типа интерферонопатии I, синдрома Айкарди-Гутьера, первоначально описанного как прогрессирующее заболевание мозга с ранним началом, выявило мутации TREX1 , RNASEh3A , RNASEh3B , RNASEh3 C, 0005 SAM1 , ADAR и MDA5 как причинные . Выявлены другие генетические причины интерферонопатий I типа. Пациенты с мутациями ISG15 , USP18 , RIG-I , STING , PSMB8 и ACP5 также демонстрируют системные особенности нарушения регуляции IFN (3, 4). Тяжесть и время начала различаются у пациентов с вышеупомянутыми интерферонопатиями I типа, даже если они несут одни и те же мутации, но неврологические и аутовоспалительные симптомы с ранним началом особенно часто встречаются при всех интерферонопатиях I типа.По сути, эти природные эксперименты говорят нам, что слишком ранний прием IFN является нейротоксичным. Следовательно, есть эволюционное преимущество в том, чтобы приручить ответ на IFN во время развития в утробе матери и в очень раннем возрасте.
Другая линия доказательств касается ситуации, в которой ответ на IFN очень слабый или отсутствует. О первых пяти людях с дефицитом STAT2, важного компонента передачи сигналов IFN, было сообщено в 2013 году. Дефицит STAT2 приводит к дефициту передачи сигналов IFN, хотя может иметь место неканоническая передача сигналов.Следует отметить, что хотя вирусное заболевание временами было более серьезным, чем обычно наблюдаемое (в частности, реакция на вакцину против кори, паротита и краснухи [MMR]), у этих пациентов наблюдался нормальный контроль вирусной инфекции Эпштейна-Барра, инфекции вируса ветряной оспы, цитомегаловируса. инфекция, неопасный для жизни гингивит, вызванный ВПГ-1, и некоторые респираторные инфекции. Один наблюдаемый случай тяжелой диссеминированной инфекции, приводящей к смерти, произошел после неизвестной вирусной инфекции у младенца, что позволяет предположить, что STAT2 может играть важную, но узкую роль в раннем детстве (5).В 2015 году у пациента-человека был обнаружен генетический дефицит самого IFNAR (гомозиготная делеция в IFNAR2, субъединице комплекса IFNAR) (6).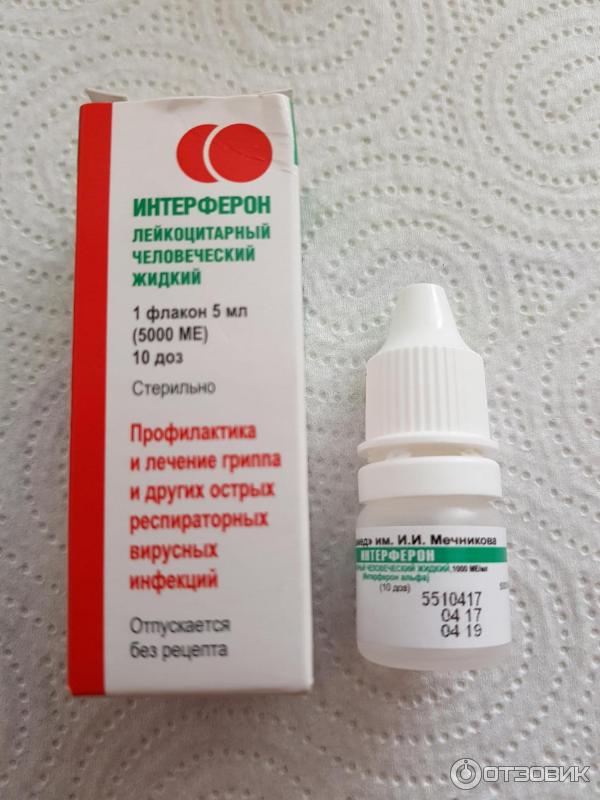 Пораженный ребенок имел нормальное внутриутробное и неонатальное развитие. В течение всего первого года жизни этого пациента никаких отклонений, связанных с распространенными вирусными инфекциями, не наблюдалось. Дефицит, смертельный в конце концов, был выявлен после вакцинации MMR (пациент был отрицательным на ВПГ-1 и ВПГ-2, а у новорожденного брата или сестры, который также является носителем мутации, все хорошо).Эти данные о дефиците IFNAR также предполагают, что IFN необходим, но только для довольно узкого спектра активности инфекций.
Пораженный ребенок имел нормальное внутриутробное и неонатальное развитие. В течение всего первого года жизни этого пациента никаких отклонений, связанных с распространенными вирусными инфекциями, не наблюдалось. Дефицит, смертельный в конце концов, был выявлен после вакцинации MMR (пациент был отрицательным на ВПГ-1 и ВПГ-2, а у новорожденного брата или сестры, который также является носителем мутации, все хорошо).Эти данные о дефиците IFNAR также предполагают, что IFN необходим, но только для довольно узкого спектра активности инфекций.
В целом, сравнение избыточной и недостаточной активности пути IFN типа I при этих недостатках у человека преподносит нам два важных физиологических урока. Во-первых, передача сигналов IFN не требуется для внутриутробного, неонатального или раннего детского развития нервной системы. Напротив, сверхактивная передача сигналов IFN вредна для развития нервной системы. Когда гиперактивность достаточно умеренная, это может привести к антивирусному фенотипу с усилением функции, что документально подтверждено при дефиците ISG15 (7). Второй ключевой вывод заключается в том, что отсутствие передачи сигналов IFN может быть фатальным, как в этом случае после вакцинации MMR, но что наиболее затронутым детям удается без осложнений контролировать наиболее распространенные детские инфекции. Таким образом, существует компромисс в отношении уровней IFN: нейротоксичность по сравнению с противовирусной активностью.
Второй ключевой вывод заключается в том, что отсутствие передачи сигналов IFN может быть фатальным, как в этом случае после вакцинации MMR, но что наиболее затронутым детям удается без осложнений контролировать наиболее распространенные детские инфекции. Таким образом, существует компромисс в отношении уровней IFN: нейротоксичность по сравнению с противовирусной активностью.
В заключение следует сказать, что данные свидетельствуют о том, что естественный отбор выбрал для нас лучший баланс, но этот баланс не идеален. Более низкие уровни IFNAR (и передачи сигналов IFN) могут защитить нас от нейротоксических эффектов IFN во время развития.После рождения, по мере того как мы постепенно теряем материнскую иммунную защиту и становимся менее чувствительными к воздействию IFN на развитие нервной системы, наша реакция на IFN возрастает, что позволяет нам контролировать вирусные инфекции. У новорожденных ВПГ, по-видимому, использует этот пробел в том, что в противном случае является благоприятным эволюционным развитием. Требуется гораздо больше работы, чтобы глубже понять инфекцию HSV-1 у новорожденных и разработать эффективные методы лечения неонатальной HSE.
Требуется гораздо больше работы, чтобы глубже понять инфекцию HSV-1 у новорожденных и разработать эффективные методы лечения неонатальной HSE.
Систематический обзор безопасности интерферона альфа
для плодаЗадний план: Интерферон альфа (IFN) является эффективным средством для лечения различных состояний, включая эссенциальную тромбоцитемию (ET), хронический миелоцитарный лейкоз, гепатиты B и C.Поскольку эти состояния также встречаются у женщин детородного возраста, которые могут забеременеть, информация о безопасности этого лекарства во время беременности имеет важное значение. В этом систематическом обзоре предпринята попытка обобщить все опубликованные данные об исходах беременностей, подвергшихся воздействию IFN-альфа, и попытаться провести различие между эффектом заболевания и действием лекарства.
Методы: Отчеты об использовании интерферона альфа при беременности человека и отчеты об эссенциальной тромбоцитемии (ЭТ) без использования каких-либо лекарств во время беременности были выявлены с помощью систематического поиска в медицинской литературе.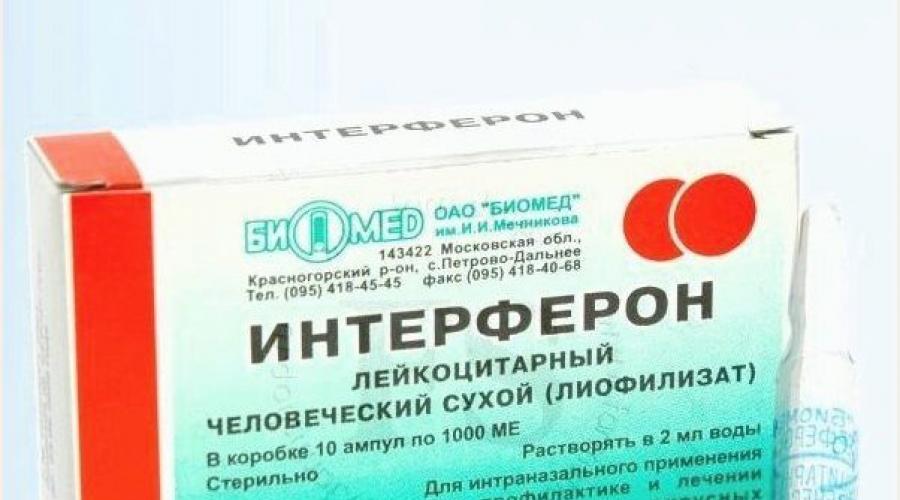 Нам удалось найти только отчеты о случаях воздействия интерферона-альфа во время беременности, у 40 из 63 которых была диагностирована ЭТ. Мы также случайным образом собрали 71 случай (больше случаев было доступно в литературе), у которых была диагностирована ЭТ из-за разной этиологии, но которые не получали никаких лекарств во время беременности.
Нам удалось найти только отчеты о случаях воздействия интерферона-альфа во время беременности, у 40 из 63 которых была диагностирована ЭТ. Мы также случайным образом собрали 71 случай (больше случаев было доступно в литературе), у которых была диагностирована ЭТ из-за разной этиологии, но которые не получали никаких лекарств во время беременности.
Полученные результаты: Среди 63 воздействий IFN-альфа во время беременности средний возраст матери составлял 30 ± 6 лет, а средний вес доношенных детей составлял 3096 ± 463 г.Средний гестационный возраст при родах составил 37 ± 3 недели. Произошло 55 одноплодных и 4 двойных беременности. О случаях серьезных пороков развития или мертворождений не сообщалось. Был один случай самопроизвольного аборта и 13 преждевременных родов (20% всех выявленных случаев). Среди 71 случая нелеченой ЭТ при беременности различной этиологии у 46 (65%) была ранняя (в течение первых 12 недель беременности) или поздняя (13-20 недель беременности) потеря беременности. Также было 3 случая (4%) мертворождения и 4 случая (5,6%) преждевременных родов.Только 18 женщин (25%) родили здоровых доношенных детей.
Также было 3 случая (4%) мертворождения и 4 случая (5,6%) преждевременных родов.Только 18 женщин (25%) родили здоровых доношенных детей.
Выводы: Результаты нашего систематического обзора показывают, что IFN-α не увеличивает значительно риск серьезных пороков развития, выкидыша, мертворождения или преждевременных родов по сравнению с обычными популяционными показателями. Также возможно, что IFN-α может иметь защитный эффект против потери беременности в случаях ET.
Распространенность младенческих исходов при рождении после воздействия интерферона…. Электронная библиотека ECTRIMS. Корхонен П. 13 сентября 2019 г .; 278346
Реферат: P1144
Тип: Стендовые сессии
Резюме Категория: Клинические аспекты РС — Беременность в РС
П. Ваттулайнен 1 , С. Буркилл 2 , Й. Гайсбюлер 3 , M. Sabidó 4 , C. Popescu 5 , K. Suzart-Woischnik 6 , K.-M. Myhr 7 , С. Монтгомери 2,8,9 , П.Корхонен 1 , Европейская группа по изучению беременности с интерфероном бета, Группа по изучению беременности и интерферона бета в странах Северной Европы
Ваттулайнен 1 , С. Буркилл 2 , Й. Гайсбюлер 3 , M. Sabidó 4 , C. Popescu 5 , K. Suzart-Woischnik 6 , K.-M. Myhr 7 , С. Монтгомери 2,8,9 , П.Корхонен 1 , Европейская группа по изучению беременности с интерфероном бета, Группа по изучению беременности и интерферона бета в странах Северной Европы
1 StatFinn и исследование EPID (компания IQVIA), Эспоо, Финляндия, 2 Каролинский институт, Стокгольм, Швеция, 3 Novartis Pharma AG, Базель, Швейцария, 4 Merck KGaA, Дармштадт, Германия, 5 Biogen Ltd, Мейденхед, Великобритания, 6 Bayer AG, Берлин, Германия, 7 Департамент неврологии, Хаукеланд Университетская больница, Берген, Норвегия, 8 Эребру Университет, Эребру, Швеция, 9 Университетский колледж Лондона, Лондон, Великобритания
Введение: Женщинам с рассеянным склерозом (РС) часто диагностируют и лечат в детородном возрасте.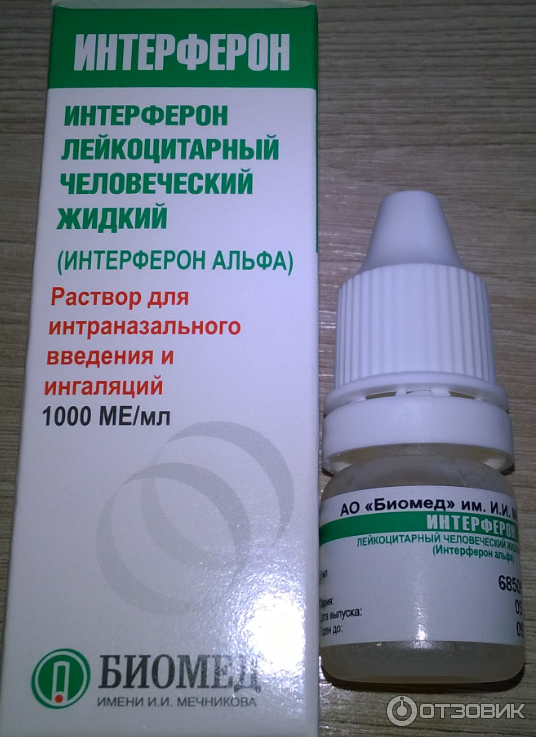 Систематические обзоры и исследования регистров показывают, что воздействие рассеянного склероза и интерферона-бета (IFNβ) может влиять на массу тела при рождении и окружность головы.
Систематические обзоры и исследования регистров показывают, что воздействие рассеянного склероза и интерферона-бета (IFNβ) может влиять на массу тела при рождении и окружность головы.
Цели: Определить распространенность категориальных показателей массы тела при рождении для гестационного возраста (малая для гестационного возраста (SGA), большая для гестационного возраста (LGA)), низкой массы тела при рождении и низкой окружности головы у беременных, подвергшихся воздействию IFNβ, и не подвергавшихся воздействию IFNβ. женщины с РС из регистров здоровья Финляндии и Швеции.
Методы: В этом когортном исследовании данные регистров здоровья из Финляндии (1996-2014) и Швеции (2005-2014) использовались для изучения женщин с РС 1) получали только IFNβ в течение 6 месяцев до даты последней менструации или во время беременности (воздействие IFNβ) и 2) без каких-либо отпускаемых лекарственных средств, модифицирующих заболевание MS (MSDMD) (без воздействия).Распространенность, с 95% доверительным интервалом (ДИ), следующих исходов родов была описана для подвергшихся воздействию IFNβ и не подвергавшихся воздействию IFNβ: SGA, LGA, низкая масса тела при рождении для живорождений и низкая окружность головы для новорожденных с доношенными живыми детьми.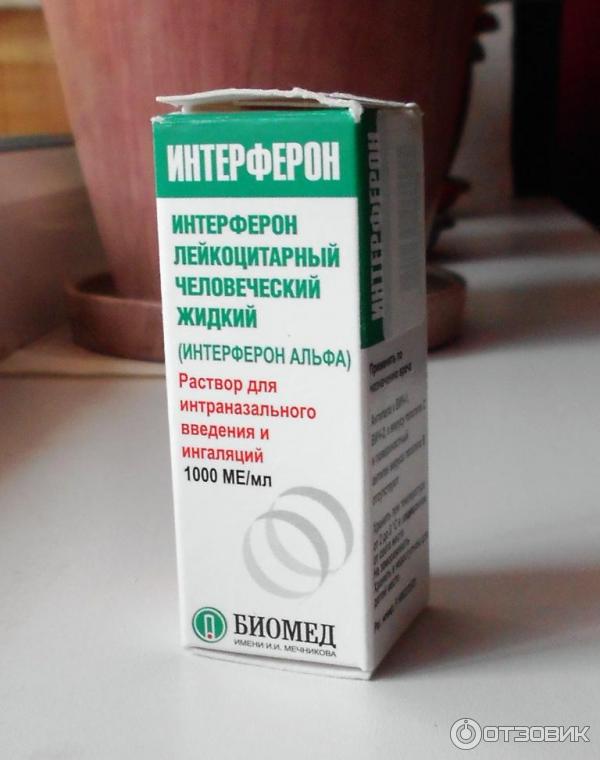 (минимум 37 недель беременности). Для SGA, LGA и окружности головы использовались национальные стандарты гестационного возраста и пола. Никаких поправок на возможные смешивающие факторы не производилось.
(минимум 37 недель беременности). Для SGA, LGA и окружности головы использовались национальные стандарты гестационного возраста и пола. Никаких поправок на возможные смешивающие факторы не производилось.
Результаты: Среди 666 живорождений, подвергшихся воздействию IFNβ, и 1330 живорождений, не подвергавшихся воздействию IFNβ, распространенность исходов у новорожденных была схожей между подвергнутыми воздействию IFNβ и не подвергавшимися воздействию.Сравнивая экспонированные и неэкспонированные, SGA составило 2,1% (95% ДИ 1,2-3,5) против 2,0% (95% ДИ 1,3-2,9) и LGA 0,8% (95% ДИ 0,2-1,7) против 0,8% (95% ДИ 0,4 Распространенность низкой массы тела при рождении составляла 3,9% (95% ДИ 2,6-5,7) среди подвергшихся воздействию IFNβ и 4,8% (95% ДИ 3,7-6,1) среди живорожденных, не подвергавшихся воздействию. Среди 619 подвергшихся воздействию IFNβ и 1219 не подвергавшихся воздействию доношенных новорожденных распространенность низкой окружности головы составила 1,9% (95% ДИ 1,0–3,4) среди подвергшихся воздействию IFNβ по сравнению с 1,1% (95% ДИ 0,6–1,8) среди новорожденных, не подвергавшихся воздействию. .
.
Выводы: Данные регистров здоровья Финляндии и Швеции не показали никаких доказательств того, что воздействие IFNβ до и во время беременности влияло на массу тела новорожденного и окружность головы.
Раскрытие информации: YG является сотрудником Novartis Pharma AG
MS является сотрудником Merck KGaA, Дармштадт, Германия
CP является сотрудником и держателем акций Biogen
KS-W является сотрудником Bayer AG
PK и PV являются сотрудниками StatFinn и EPID Research, которые проводят фармакоэпидемиологические исследования по заказу нескольких фармацевтических компаний.
K-MM получил неограниченные гранты и / или гонорары докладчиков и / или гонорары научного консультативного совета от Almirall, Biogen, Genzyme, Merck, Novartis, Sanofi-Aventis, Roche , Teva и Норвежское общество рассеянного склероза.
SM за последние пять лет получил финансирование на исследования рассеянного склероза от компаний Roche, Novartis, IQVIA и AstraZeneca; и гонорары докладчика, в том числе от Teva
SB — сотрудник Центра фармакоэпидемиологии, который получает гранты от нескольких организаций, включая фармацевтические компании
Передача сигналов материнского интерферона I типа отрицательно влияет на микроглию и поведение потомства, что сопровождается повышенной чувствительностью к стрессу

Цукерман Л., Вайнер И. Активация материнского иммунитета приводит к поведенческим и фармакологическим изменениям у взрослого потомства. J Psychiatr Res. 2005; 39: 311–23.
PubMed Google Scholar
Цукерман Л., Вайнер И. Постпубертатное возникновение нарушенного латентного торможения после пренатальной иммунной активации. Psychopharmacol. 2003. 169: 308–13.
CAS Google Scholar
Li Q, Cheung C, Wei R, Hui ES, Feldon J, Meyer U и др. Пренатальный иммунный вызов — это фактор риска окружающей среды для изменения мозга и поведения, имеющего отношение к шизофрении: данные МРТ на мышиной модели. PLoS ONE. 2009; 4: e6354.
PubMed PubMed Central Google Scholar
Чой Г.Б., Йим Ю.С., Вонг Х., Ким С., Ким Х., Ким С.В. и др. Путь материнского интерлейкина-17a у мышей способствует развитию аутистических фенотипов у потомства. Наука. 2016; 351: 933–9.
Наука. 2016; 351: 933–9.
CAS PubMed PubMed Central Google Scholar
Коричневый AS. Пренатальная инфекция как фактор риска шизофрении. Шизофр Бык. 2006; 32: 200–2.
PubMed PubMed Central Google Scholar
Миллер Б.Дж., Калпеппер Н., Рапапорт М.Х., Бакли П. Пренатальное воспаление и нейроразвитие при шизофрении: обзор исследований на людях.Prog Neuropsychopharmacol Biol Psychiatry. 2013; 42: 92–100.
CAS PubMed Google Scholar
Цучия К.Дж., Бирн М., Мортенсен ПБ. Факторы риска в связи с возникновением биполярного расстройства: систематический обзор. Биполярное расстройство. 2003; 5: 231–42.
PubMed Google Scholar
Мейер У., Фелдон Дж. К поли (I: C) или не к поли (I: C): продвижение доклинических исследований шизофрении с использованием моделей пренатальной иммунной активации. Нейрофармакология. 2012; 62: 1308–21.
Нейрофармакология. 2012; 62: 1308–21.
CAS PubMed Google Scholar
Мюррей С., Гриффин ЭУ, О’Лафлин Е., Лайонс А., Шервин Е., Ахмед С. и др. Взаимозависимые и независимые роли интерферонов типа I и IL-6 в ответах врожденного иммунитета, нейровоспалительного и болезненного поведения на системный поли I: C. Иммунное поведение мозга. 2015; 48: 274–86.
CAS PubMed PubMed Central Google Scholar
Мейер У, Фелдон Дж, Йи Б.К. Обзор гипотезы шизофрении о дисбалансе цитокинов головного мозга плода. Шизофр Бык. 2009; 35: 959–72.
PubMed Google Scholar
Смит С.П., Ли Дж., Гарбетт К., Мирникс К., Паттерсон PH. Активация материнского иммунитета изменяет развитие мозга плода через интерлейкин-6. J Neurosci. 2007. 27: 10695–702.
CAS PubMed PubMed Central Google Scholar

Arrode-Brusés G, Brusés JL. Активация материнского иммунитета с помощью поли I: C индуцирует экспрессию цитокинов IL-1β и IL-13, хемокина MCP-1 и колониестимулирующего фактора VEGF в мозге эмбриона мыши. J Нейровоспаление. 2012; 9: 83.
PubMed Google Scholar
Garbett Ka, Hsiao EY, Kálmán S, Patterson PH, Mirnics K. Эффекты материнской иммунной активации на паттерны экспрессии генов в мозге плода. Перевод Психиатрия. 2012; 2: e98.
CAS PubMed PubMed Central Google Scholar
Hsiao EY, Patterson PH. Активация материнской иммунной системы вызывает эндокринные изменения в плаценте через IL-6. Иммунное поведение мозга. 2011; 25: 604–15.
CAS PubMed Google Scholar
Алексопулу Л., Холт А.С., Меджитов Р., Флавелл Р.А. Распознавание двухцепочечной РНК и активация NF-kappaB Toll-подобным рецептором 3. Природа. 2001; 413: 732–8.
Природа. 2001; 413: 732–8.
CAS PubMed Google Scholar
Такеучи О., Акира С. Распознавание вирусов по врожденному иммунитету. Immunol Rev.2007; 220: 214–24.
CAS PubMed Google Scholar
Шульц К.С., Моссман К.Л. Стратегии уклонения от вирусов при передаче сигналов IFN типа I — краткое изложение последних разработок. Фронт Иммунол. 2016; 7: 498.
PubMed PubMed Central Google Scholar
Гарсия-Састре А. Десять стратегий уклонения от интерферона вирусами. Клеточный микроб-хозяин. 2017; 22: 176–84.
PubMed PubMed Central Google Scholar
Фейгенсон К.А., Куснецов А.В., Сильверштейн С.М. Воспаление и гипотеза двух ударов шизофрении. Neurosci Biobehav Rev.2014; 38: 72–93.
PubMed Google Scholar

Monte AS, Mello BSF, Borella VCM, da Silva Araujo T., da Silva FER, Sousa FCFde, et al.Модель с двумя ударами шизофрении, вызванной неонатальной иммунной активацией и перипубертатным стрессом у крыс: изучение половых различий и окислительных изменений мозга. Behav Brain Res. 2017; 331: 30–7.
CAS PubMed Google Scholar
Maynard TM, Sikich L, Lieberman JA, LaMantia AS. Нервное развитие, передача сигналов между клетками и гипотеза «двух ударов» шизофрении. Шизофр Бык. 2001; 27: 457–76.
CAS PubMed Google Scholar
Джованоли С., Энглер Х., Энглер А., Рикетто Дж., Фогет М., Вилли Р. и др. Стресс в период полового созревания выявляет латентные невропатологические последствия пренатальной активации иммунной системы у мышей. Наука. 2013; 339: 1095–9.
CAS PubMed Google Scholar

Heim C, Nemeroff CB. Роль детской травмы в нейробиологии расстройств настроения и тревожных расстройств: доклинические и клинические исследования. Биол Психиатрия. 2001; 49: 1023–39.
CAS PubMed Google Scholar
Цуда М.К., Огава С. Длительные последствия разлучения новорожденных с матерью на социальное поведение у самок мышей, подвергшихся овариэктомии. PLoS ONE. 2012; 7: e33028.
CAS PubMed PubMed Central Google Scholar
Michell-Robinson MA, Touil H, Healy LM, Owen DR, Durafourt BA, Bar-Or A, et al. Роль микроглии в развитии мозга, поддержании и восстановлении тканей. Мозг. 2015; 138: 1138–59.
PubMed PubMed Central Google Scholar
Nayak D, Roth TL, McGavern DB. Развитие и функция микроглии. Анну Рев Иммунол. 2014; 32: 367–402.
CAS PubMed PubMed Central Google Scholar

Агуцци А., Баррес Б.А., Беннетт М.Л. Микроглия: козел отпущения, саботажник или что-то еще? Наука. 2013; 339: 156–61.
CAS PubMed PubMed Central Google Scholar
Стивенс Б., Аллен Н.Дж., Васкес Л.Е., Хауэлл Г.Р., Кристоферсон К.С., Нури Н. и др.Классический каскад комплемента опосредует устранение синапсов ЦНС. Клетка. 2007; 131: 1164–78.
CAS PubMed Google Scholar
Шафер Д.П., Лерман Е.К., Каутцман А.Г., Кояма Р., Мардинли А.Р., Ямасаки Р. и др. Микроглия формирует постнатальные нейронные цепи в зависимости от активности и комплемента. Нейрон. 2012; 74: 691–705.
CAS PubMed PubMed Central Google Scholar
Паоличелли Р.С., Боласко Дж., Пагани Ф., Магги Л., Шианни М., Панзанелли П. и др. Синаптическая обрезка микроглией необходима для нормального развития мозга. Наука. 2011; 333: 1456–8.
Наука. 2011; 333: 1456–8.
CAS PubMed Google Scholar
Shigemoto-Mogami Y, Hoshikawa K, Goldman JE, Sekino Y, Sato K. Микроглия усиливает нейрогенез и олигодендрогенез в ранней постнатальной субвентрикулярной зоне. J Neurosci. 2014; 34: 2231–43.
CAS PubMed PubMed Central Google Scholar
Cunningham CL, Martinez-Cerdeno V, Noctor SC. Микроглия регулирует количество нервных клеток-предшественников в развивающейся коре головного мозга. J Neurosci. 2013; 33: 4216–33.
CAS PubMed PubMed Central Google Scholar
Принц М., Приллер Дж. Микроглия и макрофаги мозга в молекулярном возрасте: от происхождения до психоневрологического заболевания. Nat Rev Neurosci. 2014; 15: 300–12.
CAS PubMed Google Scholar

Rothhammer V, Borucki DM, Tjon EC, Takenaka MC, Chao C-C, Ardura-Fabregat A и др. Микроглиальный контроль астроцитов в ответ на микробные метаболиты. Природа. 2018; 557: 724–8.
CAS PubMed PubMed Central Google Scholar
Kreutzberg GW. Микроглия: датчик патологических событий в ЦНС. Trends Neurosci. 1996; 19: 312–8.
CAS PubMed Google Scholar
Пивнева Т.А. Микроглия в норме и при патологии. Физиол Ж. 2008; 54: 81–9.
CAS PubMed Google Scholar
Deczkowska A, Amit I, Schwartz M. Механизмы микроглиальных иммунных контрольных точек. Nat Neurosci. 2018; 21: 779–86.
CAS PubMed Google Scholar
Бутовский О., Едриховски М.П., Мур С.С., Сиалик Р., Лансер А.Дж., Габриэли Г. и др.Идентификация уникальной TGF-β-зависимой молекулярной и функциональной сигнатуры в микроглии. Nat Neurosci. 2013; 17: 131–43.
Nat Neurosci. 2013; 17: 131–43.
PubMed PubMed Central Google Scholar
Коэн М., Маткович О., Дэвид Э., Барнетт-Ицхаки З., Керен-Шауль Н., Блехер-Гонен Р. и др. Хроническое воздействие TGFβ1 регулирует воспалительную реакцию миелоидных клеток IRF7-зависимым образом. EMBO J. 2014; 33: 2906–21.
PubMed PubMed Central Google Scholar
Honda K, Yanai H, Negishi H, Asagiri M, Sato M, Mizutani T и др. IRF-7 является главным регулятором интерферон-зависимых иммунных ответов I типа. Природа. 2005; 434: 772–7.
CAS PubMed Google Scholar
Cronk JC, Derecki NC, Ji E, Xu Y, Lampano AE, Smirnov I, et al. Связывающий метил-CpG белок 2 регулирует экспрессию генов микроглии и макрофагов в ответ на воспалительные стимулы. Иммунитет. 2015; 42: 679–91.
CAS PubMed PubMed Central Google Scholar

Росси К., Кузимано М., Замбито М., Финарди А., Капотондо А., Гарсия-Мантейга Дж. М. и др. Интерлейкин 4 модулирует гомеостаз микроглии и ослабляет раннюю, медленно прогрессирующую фазу бокового амиотрофического склероза. Cell Death Dis. 2018; 9: 250.
PubMed PubMed Central Google Scholar
Лобо-Силва Д., Карриче Г.М., Кастро А.Г., Роке С., Сараива М. Интерферон-β регулирует выработку IL-10 микроглией, активируемой толл-подобными рецепторами. Глия. 2017; 65: 1439–51.
PubMed PubMed Central Google Scholar
Goldmann T, Zeller N, Raasch J, Kierdorf K, Frenzel K, Ketscher L, et al. Недостаток USP18 в микроглии вызывает деструктивную интерферонопатию головного мозга мыши. EMBO J. 2015; 34: 1612–29.
CAS PubMed PubMed Central Google Scholar
Meuwissen MEC, Schot R, Buta S, Oudesluijs G, Tinschert S, Speer SD, et al.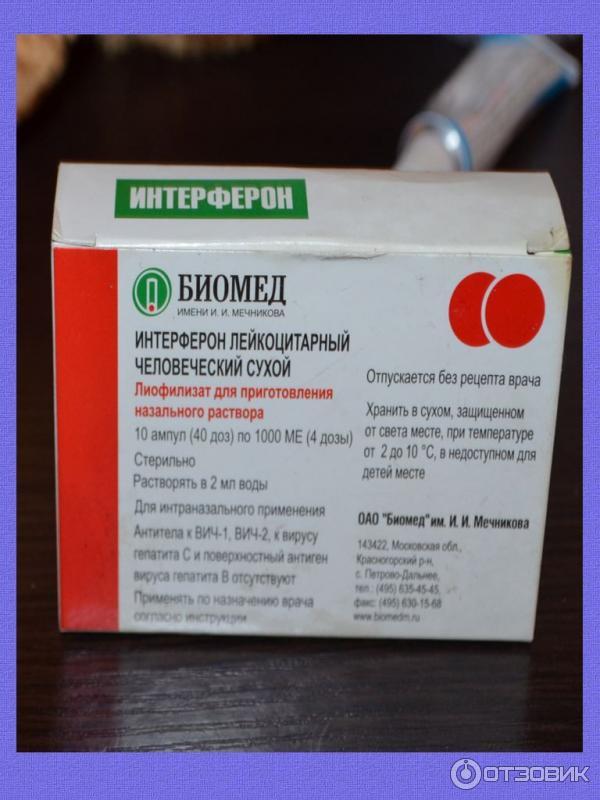 Дефицит USP18 у человека лежит в основе интерферонопатии 1 типа, приводящей к тяжелому псевдо-TORCH-синдрому. J Exp Med. 2016; 213: 1163–74.
Дефицит USP18 у человека лежит в основе интерферонопатии 1 типа, приводящей к тяжелому псевдо-TORCH-синдрому. J Exp Med. 2016; 213: 1163–74.
PubMed PubMed Central Google Scholar
Deczkowska A, Matcovitch-Natan O, Tsitsou-Kampeli A, Ben-Hamo S, Dvir-Szternfeld R, Spinrad A, et al. Mef2C сдерживает воспалительную реакцию микроглии и теряется при старении мозга в зависимости от IFN-I.Nat Commun. 2017; 8: 717.
PubMed PubMed Central Google Scholar
Smolders S, Smolders SMT, Swinnen N, Gärtner A, Rigo J-M, Legendre P, et al. Активация материнского иммунитета, вызванная полиинозиновой: полицитидиловая кислота не вызывает активации микроглиальных клеток у эмбриона. Front Cell Neurosci. 2015; 9: 301.
PubMed PubMed Central Google Scholar
Джованоли С., Ноттер Т., Рикетто Дж. , Лабуэсс Массачусетс, Вильермот С., Рива М.А. и др. Поздняя пренатальная иммунная активация вызывает дефицит гиппокампа в отсутствие стойкого воспаления при старении. J Нейровоспаление. 2015; 12: 221.
, Лабуэсс Массачусетс, Вильермот С., Рива М.А. и др. Поздняя пренатальная иммунная активация вызывает дефицит гиппокампа в отсутствие стойкого воспаления при старении. J Нейровоспаление. 2015; 12: 221.
PubMed PubMed Central Google Scholar
Giovanoli S, Weber-Stadlbauer U, Schedlowski M, Meyer U, Engler H. Пренатальная иммунная активация вызывает гиппокампальный синаптический дефицит в отсутствие явных аномалий микроглии.Иммунное поведение мозга. 2016; 55: 25–38.
CAS PubMed Google Scholar
Patrich E, Piontkewitz Y, Peretz A, Weiner I., Attali B. Активация материнского иммунитета вызывает дефекты возбудимости новорожденных в нейронах гиппокампа потомков беременных крыс, обработанных поли I: C. Научный доклад 2016; 6: 19106.
CAS PubMed PubMed Central Google Scholar
Zhang Z, van Praag H. Активация материнского иммунитета по-разному влияет на зрелые и взрослые нейроны гиппокампа мышей-самцов. Иммунное поведение мозга. 2015; 45: 60–70.
PubMed Google Scholar
Coiro P, Padmashri R, Suresh A, Spartz E, Pendyala G, Chou S, et al. Нарушение синаптического развития в модели мышей с активацией иммунной системы материнской нервной системы. Иммунное поведение мозга. 2015; 50: 249–58.
PubMed PubMed Central Google Scholar
Sekar A, Bialas AR, de Rivera H, Davis A, Hammond TR, Kamitaki N, et al. Риск шизофрении из-за сложных вариаций компонента 4 комплемента. Природа. 2016; 530: 177–83.
CAS PubMed PubMed Central Google Scholar
Жан Й., Паоличелли Р.С., Сфораццини Ф., Вайнхард Л., Боласко Дж., Пагани Ф. и др. Недостаточная передача сигналов между нейронами и микроглией приводит к нарушению функциональной связи мозга и нарушению социального поведения. Nat Neurosci.2014; 17: 400–6.
Nat Neurosci.2014; 17: 400–6.
CAS PubMed Google Scholar
Eßlinger M, Wachholz S, Manitz M-P, Plümper J, Sommer R, Juckel G, et al. Связанный с шизофренией дефицит сенсорного гейтинга развивается после активации микроглии в подростковом возрасте. Иммунное поведение мозга. 2016; 58: 99–106.
PubMed Google Scholar
Prinz M, Schmidt H, Mildner A, Knobeloch K-P, Hanisch U-K, Raasch J, et al.Определенные и неизбыточные функции IFNAR in vivo на миелоидных клетках ограничивают аутоиммунитет в центральной нервной системе. Иммунитет. 2008. 28: 675–86.
CAS PubMed Google Scholar
Юнг С., Алиберти Дж., Грэммель П., Саншайн М.Дж., Крейцберг Г.В., Шер А. и др. Анализ функции фракталкинового рецептора CX3CR1 путем целенаправленной делеции и вставки репортерного гена зеленого флуоресцентного белка. Mol Cell Biol. 2000; 20: 4106–14.
Mol Cell Biol. 2000; 20: 4106–14.
CAS PubMed PubMed Central Google Scholar
Meyer U, Nyffeler M, Schwendener S, Knuesel I, Yee BK, Feldon J. Относительный пренатальный и постнатальный материнский вклад в нейрохимическую дисфункцию, связанную с шизофренией, после внутриутробного иммунного заражения. Нейропсихофармакология. 2008; 33: 441–56.
PubMed Google Scholar
Meyer U, Nyffeler M, Engler A, Urwyler A, Schedlowski M, Knuesel I, et al. Время пренатального иммунного заражения определяет специфичность опосредованной воспалением головного мозга и поведенческой патологии.J Neurosci. 2006; 26: 4752–62.
CAS PubMed PubMed Central Google Scholar
Sheehan KCF, Lai KS, Dunn GP, Bruce AT, Diamond MS, Heutel JD, et al. Блокирование моноклональных антител, специфичных к субъединице 1 мышиного IFN-альфа / бета-рецептора (IFNAR-1), от мышей, иммунизированных гидродинамической трансфекцией in vivo.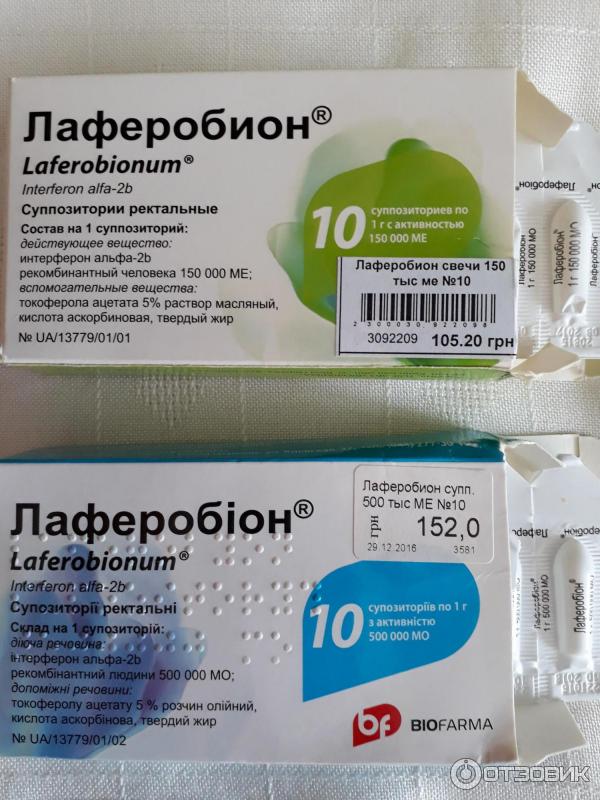 J Interferon Cytokine Res. 2006; 26: 804–19.
J Interferon Cytokine Res. 2006; 26: 804–19.
CAS PubMed Google Scholar
Belardelli F, Gabriele L, Proietti E, Sestili P, Peretti M, Rozera C и др. Синергетические противоопухолевые эффекты комбинированной терапии ИЛ-1 / ИФН-α / β у мышей, которым вводили метастатические дружественные эритролейкозные клетки. Int J Cancer. 1991; 49: 274–8.
CAS PubMed Google Scholar
Лю Х-И, Лю З-К, Чао Х, Ли З, Сонг З, Ян И и др. Интерферон-γ в высоких дозах способствует выкидышу у мышей, подавляя поляризацию Treg и Th27.J Inter Cytokine Res. 2014; 34: 394.
CAS Google Scholar
Кларк И.А., Чаудри Г. Фактор некроза опухоли при аборте, вызванном малярией. Am J Trop Med Hyg. 1988; 39: 246–9.
CAS PubMed Google Scholar

Roque A, Ochoa-Zarzosa A, Torner L. Материнское разделение активирует микроглиальные клетки и вызывает воспалительную реакцию в гиппокампе крысят-самцов, независимо от уровней гипоталамуса и периферических цитокинов.Иммунное поведение мозга. 2016; 55: 39–48.
CAS PubMed Google Scholar
Дьякон RMJ. Рытье и закапывание мрамора в мышей: простые методы определения биологических воздействий in vivo. Nat Protoc. 2006; 1: 122–4.
CAS PubMed Google Scholar
Томас А., Бурант А., Буи Н., Грэм Д., Юва-Пейлор Л.А., Пейлор Р. Захоронение Марбла отражает повторяющееся и настойчивое поведение больше, чем тревожность, вызванную новизной.Психофармакология. 2009; 204: 361–73.
CAS PubMed PubMed Central Google Scholar
Walf AA, Frye CA. Использование приподнятого крестообразного лабиринта для анализа тревожного поведения у грызунов. Nat Protoc. 2007; 2: 322–8.
Nat Protoc. 2007; 2: 322–8.
CAS PubMed PubMed Central Google Scholar
Мой С., Надлер Дж., Перес А., Барбаро Р.П., Джонс Дж. М., Магнусон Т. Р. и др.Коммуникабельность и предпочтение социальной новизны в пяти инбредных линиях: подход к оценке аутичного поведения у мышей. Гены поведения мозга. 2004; 3: 287–302.
CAS PubMed Google Scholar
Гулд Т.Д., Дао Д.Т., Ковачич СЕ. Тест в открытом поле. в фенотипах, связанных с настроением и тревогой, у мышей. Нейрометоды. 2009; 42: 1–20.
Google Scholar
Seibenhener ML, Wooten MC.Использование лабиринта открытого поля для измерения двигательного и тревожного поведения мышей. J Vis Exp. 2015; 96: e52434.
Hughes RN. Значение спонтанного альтернированного поведения (SAB) как теста на удержание в фармакологических исследованиях памяти. Neurosci Biobehav Rev.2004; 28: 497–505.
Neurosci Biobehav Rev.2004; 28: 497–505.
CAS PubMed Google Scholar
Козу Й., Мория Т., Такешима Х., Йошиока Т., Шибата С. Мутантные мыши, лишенные рианодинового рецептора 3 типа, демонстрируют дефицит контекстного кондиционирования страха и активации кальций / кальмодулин-зависимой протеинкиназы II в гиппокампе.Mol Brain Res. 2000; 76: 142–50.
CAS PubMed Google Scholar
Джайтин Д.А., Кенигсберг Э., Керен-Шауль Х., Элефант Н., Пауль Ф., Зарецкий И. и др. Массивно-параллельная одноклеточная последовательность РНК для безмаркерного разложения тканей на типы клеток. Наука. 2014; 343: 776–9.
CAS PubMed PubMed Central Google Scholar
Маткович-Натан О., Винтер Д.Р., Гилади А., Варгас Агилар С., Спинрад А., Сарразин С. и др.Развитие микроглии следует поэтапной программе регулирования гомеостаза мозга. Наука. 2016; 353: aad8670.
Наука. 2016; 353: aad8670.
PubMed Google Scholar
Trapnell C, Pachter L, Salzberg SL. TopHat: обнаружение сплайсинговых соединений с помощью RNA-Seq. Биоинформатика. 2009. 25: 1105–11.
CAS PubMed PubMed Central Google Scholar
Heinz S, Benner C, Spann N, Bertolino E, Lin YC, Laslo P, et al.Простые комбинации факторов транскрипции, определяющих клонирование, активируют цис-регуляторные элементы, необходимые для идентичности макрофагов и В-клеток. Mol Cell. 2010; 38: 576–89.
CAS PubMed PubMed Central Google Scholar
Эшбернер М., Болл С.А., Блейк Дж. А., Ботштейн Д., Батлер Н., Черри Дж. М. и др. Генная онтология: инструмент для объединения биологии. Консорциум генных онтологий. Нат Жене. 2000; 25: 25–9.
CAS PubMed PubMed Central Google Scholar

Carbon S, Dietze H, Lewis SE, Mungall CJ, Munoz-Torres MC, Basu S и др. Расширение базы знаний и ресурсов по онтологии генов: консорциум генных онтологий. Nucleic Acids Res. 2017; 45: D331–8.
CAS Google Scholar
Иден Э., Липсон Д., Йогев С., Яхини З. Обнаружение мотивов в ранжированных списках последовательностей ДНК. PLoS Comput Biol. 2007; 3: 0508–22.
CAS Google Scholar
Eden E, Navon R, Steinfeld I, Lipson D, Yakhini Z. GOrilla: инструмент для обнаружения и визуализации обогащенных терминов GO в ранжированных списках генов. BMC Bioinform. 2009; 10: 48.
Google Scholar
Русинова И., Форстер С., Ю С., Каннан А., Массе М., Камминг Х. и др. Интерфером v2.0: обновленная база данных аннотированных генов, регулируемых интерфероном. Nucleic Acids Res. 2013; 41: D1040–6.
CAS PubMed Google Scholar

Ginhoux F, Greter M, Leboeuf M, Nandi S, See P, Gokhan S, et al. Анализ картирования судьбы показывает, что взрослая микроглия происходит от примитивных макрофагов. Наука. 2010; 330: 841–5.
CAS PubMed PubMed Central Google Scholar
Schulz C, Gomez Perdiguero E, Chorro L, Szabo-Rogers H, Cagnard N, Kierdorf K, et al. Линия миелоидных клеток, независимая от Myb и гемопоэтических стволовых клеток. Наука. 2012; 336: 86–90.
CAS PubMed Google Scholar
Tak PP, Firestein GS. NF-kappaB: ключевая роль в воспалительных заболеваниях. J Clin исследования. 2001; 107: 7–11.
CAS PubMed Google Scholar
Greter M, Lelios I, Croxford AL. Микроглия против номенклатуры миелоидных клеток при воспалении головного мозга. Фронт Иммунол. 2015; 6: 249.
PubMed PubMed Central Google Scholar

Ито Д., Танака К., Сузуки С., Дембо Т., Фукуучи Ю. Повышенная экспрессия Iba1, ионизированной кальций-связывающей адаптерной молекулы 1, после временной фокальной церебральной ишемии в головном мозге крысы. Инсульт. 2001; 32: 1208–15.
CAS PubMed Google Scholar
Basil P, Li Q, Dempster EL, Mill J, Sham P-C, Wong CCY, et al. Пренатальная активация материнского иммунитета вызывает эпигенетические различия в мозге мышей-подростков. Перевод Психиатрия. 2014; 4: e434.
CAS PubMed PubMed Central Google Scholar
Richetto J, Massart R, Weber-Stadlbauer U, Szyf M, Riva MA, Meyer U. Изменения метилирования ДНК по всему геному в мышиной модели инфекционных расстройств нервного развития. Биол Психиатрия. 2017; 81: 265–76.
CAS PubMed Google Scholar
Juckel G, Manitz MP, Brüne M, Friebe A, Heneka MT, Wolf RJ.Активация микроглии в модели шизофрении с нейровоспалением на животных — пилотное исследование. Schizophr Res. 2011; 131: 96–100.
PubMed Google Scholar
Manitz MP, Plümper J, Demir S, Ahrens M, Eßlinger M, Wachholz S, et al. Проточно-цитометрическая характеристика микроглии у потомков мышей, обработанных polyI: C. Brain Res. 2016; 1636: 172–82.
CAS PubMed Google Scholar
Маттей Д., Иванов А., Феррай С., Джордан П., Гунейкая Д., Буонфиглиоли А. и др. Активация материнского иммунитета приводит к появлению сложной сигнатуры транскриптома микроглии у взрослого потомства, которая отменяется лечением миноциклином. Перевод Психиатрия. 2017; 7: e1120.
CAS PubMed PubMed Central Google Scholar
Garay Pa, Hsiao EY, Patterson PH, McAllister a. K. Активация материнского иммунитета вызывает возрастные и региональные изменения цитокинов головного мозга у потомства на протяжении всего развития.Иммунное поведение мозга. 2013; 31: 54–68.
CAS PubMed Google Scholar
Вилли Р., Хармайер А., Джованоли С., Мейер У. Измененная передача сигналов GSK3β в модели нейропсихиатрического заболевания на основе инфекции у мышей. Нейрофармакология. 2013; 73: 56–65.
CAS PubMed Google Scholar
Haller O, Kochs G, Weber F. Схема ответа интерферона: индукция и подавление патогенными вирусами.Вирусология. 2006; 344: 119–30.
CAS PubMed Google Scholar
Йоки Л.Дж., Хурадо К.А., Арора Н., Миллет А., Ракиб Т., Милано К.М. и др. Интерфероны типа I провоцируют гибель плода после инфицирования вирусом Зика. Sci Immunol. 2018; 3: eaao1680.
PubMed PubMed Central Google Scholar
Эсен Н., Рейни-Баргер Е.К., Хубер А.К., Блейкли П.К., Ирани Д.Н. Интерфероны типа I подавляют продукцию лимфоидного хемокина, CXCL13, микроглией.Глия. 2014; 62: 1452–62.
PubMed PubMed Central Google Scholar
Bialas AR, Presumey J, Das A, van der Poel CE, Lapchak PH, Mesin L, et al. Зависимая от микроглии потеря синапсов при волчанке, опосредованной интерфероном I. Природа. 2017; 546: 539.
CAS PubMed Google Scholar
Hwang SY, Hertzog PJ, Holland KA, Sumarsono SH, Tymms MJ, Hamilton JA, et al.Нулевая мутация в гене, кодирующем компонент рецептора интерферона I типа, устраняет антипролиферативные и противовирусные ответы на интерфероны альфа и бета и изменяет ответы макрофагов. Proc Natl Acad Sci USA. 1995; 92: 11284–8.
CAS PubMed Google Scholar
Hertzog PJ, Hwang SY, Kola I. Роль интерферонов в регуляции пролиферации, дифференцировки и развития клеток. Mol Reprod Dev. 1994; 39: 226–32.
PubMed Google Scholar
Мейер У. Пренатальное воздействие поли (I: C) и другие модели иммунной активации развития в системах грызунов. Биол Психиатрия. 2014; 75: 307–15.
CAS PubMed Google Scholar
Pålsson-McDermott EM, O’Neill LAJ. Передача сигнала липополисахаридным рецептором, Toll-подобным рецептором-4. Иммунология. 2004. 113: 153–62.
PubMed PubMed Central Google Scholar
Барух К., Дечковска А., Дэвид Е., Кастеллано Дж. М., Миллер О., Керцер А. и др. Вызванный старением ответ интерферона типа I в сосудистом сплетении отрицательно влияет на функцию мозга. Наука. 2014; 346: 89–93.
CAS PubMed PubMed Central Google Scholar
Río J, Tintoré M, Nos C, Téllez N, Galán I, Montalban X.Интерферон бета при ремиттирующем рассеянном склерозе. J Neurol. 2005; 252: 795–800.
PubMed Google Scholar
Группа TIMSS. Интерферон бета-1b эффективен при ремиттирующем рассеянном склерозе. I. Клинические результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования. Группа изучения рассеянного склероза IFNB. Неврология. 1993; 43: 655–61.
Google Scholar
Kuo P-C, Scofield BA, Yu I-C, Chang F-L, Ganea D, Yen JH. Интерферон-β модулирует воспалительную реакцию при ишемии головного мозга. J Am Heart Assoc. 2016; 5: 1–16.
Google Scholar
Cavanaugh SE, Holmgren AM, Rall GF. Экспрессия гомеостатического интерферона в нейронах достаточна для раннего контроля вирусной инфекции. J Neuroimmunol. 2015; 279: 11–9.
CAS PubMed Google Scholar
Эйлерсков П., Халтберг Дж., Ван Дж., Карлссон Р., Амбьёрн М., Кусс М. и др. Недостаток нейронального IFN-β-IFNAR вызывает деменцию, подобную тельцам Леви и болезни Паркинсона. Клетка. 2015; 163: 324–39.
CAS PubMed PubMed Central Google Scholar
Lord C, Elsabbagh M, Baird G, Veenstra-Vanderweele J. Расстройство аутистического спектра. Ланцет. 2018; 392: 508–20.
PubMed Google Scholar
Hommer RE, Swedo SE. Шизофрения и расстройства, связанные с аутизмом. Шизофр Бык. 2015; 41: 313–4.
PubMed PubMed Central Google Scholar
Gaebel W, Barch DM, Bustillo J, Gur RE, Heckers S, Malaspina D, et al. Определение и описание шизофрении в DSM-5. Schizophr Res. 2013; 150: 3–10.
PubMed Google Scholar
Оуэн М.Дж., Сава А., Мортенсен ПБ.Шизофрения. Ланцет. 2016; 388: 86–97.
PubMed PubMed Central Google Scholar
Temmingh H, Stein DJ. Беспокойство у больных шизофренией: эпидемиология и лечение. Препараты ЦНС. 2015; 29: 819–32.
PubMed Google Scholar
Американская психиатрическая ассоциация. Расстройства нервного развития. В кн .: Диагностическое и статистическое руководство психических расстройств (5-е изд.). Американская психиатрическая ассоциация; Арлингтон, 2013 г. https://doi.org/10.1176/appi.books.97808
Американская психиатрическая ассоциация. Спектр шизофрении и другие психотические расстройства. В кн .: Диагностическое и статистическое руководство психических расстройств (5-е изд.). Американская психиатрическая ассоциация; Арлингтон, 2013. https://doi.org/10.1176/appi.books.97808
Edgin JO, Pennington BF. Пространственное познание при расстройствах аутистического спектра: превосходное, нарушенное или просто нетронутое? J Autism Dev Disord.2005. 35: 729–45.
PubMed Google Scholar
Beversdorf DQ, Smith BW, Crucian GP, Anderson JM, Keillor JM, Barrett AM, et al. Повышенная дискриминация «ложных воспоминаний» при расстройстве аутистического спектра. Proc Natl Acad Sci USA. 2000; 97: 8734–7.
CAS PubMed Google Scholar
Miró X, Meier S, Dreisow ML, Frank J, Strohmaier J, Breuer R, et al.Исследования на людях и мышах указывают на причастность нейрокана к этиологии мании. Am J Psychiatry. 2012; 169: 982–90.
PubMed Google Scholar
Активация системы IFN типа I у новорожденных, подвергшихся воздействию аутоантител Ro / SSA и La / SSB внутриутробно
Ключевые сообщения
Что уже известно об этом предмете?
Внутриутробное воздействие на плод материнских аутоантител Ro / La может привести к врожденной блокаде сердца у плода, причем недавние исследования указывают на активацию интерферона (IFN) в фибробластах сердца плода.
Что добавляет это исследование?
Это исследование демонстрирует, что новорожденные, подвергшиеся воздействию аутоантител Ro / La, имеют признаки активированной иммунной системы с сигнатурой IFN и что иммуномодулирующее лечение матери может снизить экспрессию IFN-индуцированного гена в клетках новорожденных.
В этом исследовании мы наблюдаем, что неонатальные клетки могут продуцировать IFNα при воздействии плазмы, содержащей аутоантитела.
Как это может повлиять на клиническую практику?
Лечение матерей иммуномодулирующими препаратами было предложено для защиты от врожденной блокады сердца (ВГБ), и наше исследование обеспечивает молекулярную основу для такого потенциального защитного эффекта.
Показатель материнского IFN при беременности, положительной по анти-Ro / La, потенциально может быть использован в качестве биомаркера риска ХГВ.
Введение
Системная красная волчанка (СКВ) и синдром Шегрена (СС) — это системные аутоиммунные заболевания, характеризующиеся вовлечением множества органов и циркулирующими аутоантителами против внутриклеточных антигенов, таких как Ro / SSA и La / SSB.1–3 Эти аутоантитела в комплекс с рибонуклеопротеинами, может индуцировать продукцию интерферона (IFN) α плазматическими дендритными клетками и мононуклеарными клетками периферической крови (PBMC).4 5 Соответственно, повышенные уровни IFN типа I в сыворотке и сверхэкспрессия генов, стимулированных IFN I типа (сигнатура IFN), обнаруживаются как в SLE, так и в SS.6 7 IFN типа I влияет как на врожденную, так и на адаптивную иммунную системы и способствует потере толерантность и развитие аутоиммунных заболеваний.8, 9 Недавно было сообщено о сильном влиянии ИФН типа I на нейрональную синаптическую массу центральной нервной системы (ЦНС ).10 Часто применяемые методы лечения как при СКВ, так и при СС, такие как гидроксихлорохин и глюкокортикоиды, были предложено уменьшить активность системы IFN типа I, и было разработано несколько новых лекарств для непосредственного воздействия на пути, связанные с IFN.8 9
Во время беременности IgG транспортируется через плаценту, а аутоантитела Ro / SSA и La / SSB передаются плоду.11 12 Присутствие этих аутоантител у матери связано с риском возникновения красной волчанки у новорожденных (NLE). ребенок 13–15 Синдром включает врожденную блокаду сердца (ВГБ), кожные проявления, поражение печени и гематологические заболевания. 16 17
Хорошо известно, что взрослые иммунные клетки могут продуцировать IFN типа I при воздействии аутоантител Ro / SSA и La / SSB в сочетании с апоптотическим / некротическим материалом, но неизвестно, способны ли фетальные клетки в равной степени к такому ответу.Кроме того, хотя известно, что наличие аутоантител к Ro / SSA и La / SSB связано с сигнатурой IFN у пациентов с СКВ и СС, не исследовалось, происходит ли активация системы IFN типа I также у плодов, подвергшихся воздействию Ro / SSA и La / SSB во время беременности, и может ли на это повлиять иммуномодулирующее лечение матери. Чтобы ответить на эти вопросы, мы взяли пробы материнской и неонатальной крови при рождении от Ro / SSA и La / SSB положительных по аутоантителам, леченных или нелеченных беременных, а также от контрольных пар мать-новорожденный, и проанализировали экспрессию генов, клеточную активацию и уровни IFN типа I у матерей и новорожденных.
Пациенты и методы
Популяция исследования
Беременные женщины с анти-Ro / SSA и анти-La / SSB под наблюдением с помощью допплеровской эхокардиографии были набраны в отделении детской кардиологии больницы Каролинского университета, Швеция (n = 25). Ни одна мать не родила ребенка с ХГВ. Здоровые контрольные группы были набраны в отделении родовспоможения той же больницы (n = 25). Кровь брали у матери и из пуповины при родах. Данные о материнском диагнозе и лечении, а также о гестационном возрасте, поле, весе и длине новорожденных представлены в таблице 1.Образцы, доступные для соответствующего анализа, указаны в подписях к рисункам.
Таблица 1Клинические характеристики включенных матерей и новорожденных
Подготовка образцов
Образцы крови были обработаны сразу после родов. Сначала отбирали аликвоты для проточной цитометрии, а затем образцы центрифугировали при 1200 g в течение 10 мин, собирали плазму / сыворотку, разделяли на аликвоты и замораживали при -80 ° C. РВМС выделяли с помощью пробирок SepMate-50 (Stemcell Technologies) в соответствии с инструкциями производителя и замораживали в эмбриональной сыворотке теленка с 10% диметилсульфоксидом (ДМСО) в жидком азоте.Аликвоты клеток также хранили в более позднем растворе РНК (ThermoFisher Scientific) или в тризоле (ThermoFisher Scientific).
Выделение РНК
Клетки, хранящиеся в РНК, позже разбавляли 2-кратным объемом ледяного PBS, клетки, хранящиеся в Trizol, экстрагировали хлороформом. РНК выделяли с помощью мини-набора RNAeasy в соответствии с инструкциями производителя (Qiagen).
Микроматрицы и анализ
Анализ РНК был проведен в The BEA Core Facility, Департамент биологических наук и питания, Каролинский институт, с использованием Affymetrix HTA V.2.0 микрочипов. Дифференциально экспрессируемые гены идентифицировали с использованием модуля сравнительного выбора маркеров в GenePattern18 с использованием двустороннего t-критерия с 0 перестановками в логарифмически преобразованных данных. Было обнаружено, что гены, по-разному экспрессирующиеся между группами, были визуализированы и иерархически сгруппированы с использованием Morpheus (software.broadinstitute.org/morpheus/). База данных молекулярных сигнатур V.6.2 была использована для анализа обогащения набора генов (software.broadinstitute.org/gsea/msigdb), чтобы найти термины генной онтологии (GO), которые избыточно представлены среди самых популярных (p≤1E-04) дифференциально регулируемых гены и выбранные термины GO, визуализированные с помощью Morpheus.Обогащение пути визуализировали с помощью пакета R circlize. 19
баллов IFN
баллов IFN были рассчитаны как Z-баллы, как описано ранее, 20 с использованием 13 IFN-регулируемых генов ( ISG15, IFI44, STAT1, PLSCR1, LY6E, IFIT1, IRF7, OAS1, OAS2, OASL, MX1, MX2 и IFIT3 ).
ELISA
Аутоантитела к Ro52, Ro60 и La были обнаружены с помощью ELISA (Orgenetec, Mainz, Germany) в соответствии с инструкциями производителя. Образцы тестировали в двух экземплярах при 1: 500 и измеряли оптическую плотность при 450 нм.Каждый планшет содержал не менее двух положительных и двух отрицательных контрольных сывороток.
IFNα-анализы
IFNα измеряли с помощью фториоиммуноанализа лантаноидов с усиленной диссоциацией (DELFIA), как описано ранее.21 Короче говоря, 96-луночные планшеты (Maxisorp, Fluoronunc) были покрыты одним (анализ супернатанта) или двумя (анализ плазмы ) мышиных моноклональных антител против IFNα (mAb), LT27: 273 (2 мкг / мл) и LT27: 293 (5 мкг / мл) для захвата и меченного европием mAb против IFNα LT27: 297 (5 мкг / мл).Для уменьшения фона буфер для разведения (50 мМ Трис-HCl, 0,9% NaCl, 0,5 мМ CaCl 2 × 2 H 2 O, 20 мкМ ЭДТА, 0,5% BSA, 0,005% NaN 3, pH 7,8) был дополнен нерелевантным мышиным mAb (50 мкг / мл). После инкубации с mAb в промытые лунки добавляли усиливающий раствор (Perkin-Elmer) и измеряли флуоресценцию при 600 нм на флуорометре (Wallac). Стандарт иммуноанализа на IFNα был откалиброван по эталонному лейкоцитарному IFNα GA-23-902-530 NIH.
Окрашивание и анализ проточной цитометрии
Цельную кровь с ЭДТА инкубировали в течение 15 мин при комнатной температуре с зеленым красителем види (Thermofisher, исх.L23101) и коктейль антител, содержащий: Ig-подобный лектин 1 (SIGLEC-1), связывающий с сиаловой кислотой, PE (клон 7–239, ссылка 565248), анти-HLA-ABC PE-Cy5 (клон G46-2.6, ссылка 555554), анти-CD3 PE-Cy7 (клон SK7, ссылка 557851), анти-CD19 APC (клон HIB19, ссылка 555415), анти-CD14 PB (клон M5E2, ссылка 558121), анти-CD16 BV510 (клон 3G8, ссылка 563829), все от Becton Dickinson, и анти-HLA-DR APC-Cy7 (клон L243, ссылка 307618), BioLegend. Образцы инкубировали в течение 5 минут при комнатной температуре с буфером для лизиса эритроцитов (Becton Dickinson, ref.555899), оставшиеся лейкоциты промывали PBS, и данные получали с помощью проточного цитометра Gallios (Beckman Coulter). Стратегия стробирования визуализирована на дополнительном онлайн-рисунке 1. Анализ данных проводился с помощью программного обеспечения FlowJo (V.10.4.2, Tree Star).
Клеточные культуры
PBMC (0,2 × 10 6 ) от новорожденных и их матерей стимулировали в 96-луночных плоскодонных микротитровальных планшетах (Nunc, Дания) 0,1% (об. / Об.) Плазмы, состоящей из пула. Ro / SSA и La / SSB положительной плазмы от трех новорожденных и трех матерей, соответственно.К клеточным культурам добавляли 500 ед / мл IntronA (Schering-Pllow, Bloomfield, Нью-Джерси, США) и супернатант некротических клеток, приготовленный циклами замораживания-оттаивания, как описано ранее, 22 и инкубировали в течение 20 часов при 37 ° C с 5 % CO 2 . IFNα в супернатантах анализировали иммуноанализом DELFIA.21
Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения GraphPad PRISM V.6 (Сан-Диего, Калифорния, США), за исключением данных микрочипов. Различия между тремя группами анализировали с помощью однофакторного дисперсионного анализа и критерия множественного сравнения Тьюки, а между двумя группами — с помощью непарного t-критерия, когда данные проходили тест Колмогорова-Смирнова на нормальность.Когда нельзя было предположить нормальность, вместо этого использовался тест Краскела-Уоллиса с тестом множественных сравнений Данна или тест Манна-Уитни. Для оценки корреляции был рассчитан коэффициент ранговой корреляции Спирмена. Порог значимости везде был установлен на p = 0,05.
Результаты
Профиль экспрессии генов у новорожденных, рожденных от анти-Ro / La положительных матерей
Анализ экспрессии генов PBMC, очищенных из материнской крови при родах, показал значительные различия в экспрессии большого набора генов между анти-Ro / La. La аутоантитело-положительная и контрольная группы с 1795 генами, у которых коэффициент ложного обнаружения (FDR) ≤0.1 (рисунок 1А). Примечательно, что анализ экспрессии генов в пуповинной крови новорожденных — PBMC показал, что новорожденные от анти-Ro / La положительных матерей также дифференциально экспрессировали большое количество генов по сравнению с новорожденными из здоровой контрольной группы, при этом 1893 гена проходят FDR≤0,1 (рисунок 1A). Совпадение дифференциально экспрессируемых генов в материнской и неонатальной группах составило 910.
Рисунок 1Различия в экспрессии генов в мононуклеарных клетках периферической крови анти-Ro / La положительных матерей, здоровых контрольных матерей и их соответствующих новорожденных.(A) Визуализация тепловой карты генов, дифференцированно регулируемых между здоровыми контрольными матерями и анти-Ro / La положительными (Ro / La +) матерями без иммуномодулирующего лечения (FDR <0,1, n = 1795) и у новорожденных (новорожденные, образцы пуповинной крови) матерей контрольной группы по сравнению с новорожденными от матерей типа Ro / La + (FDR <0,1, n = 1893). Гены и образцы визуализируются и иерархически группируются с помощью Morpheus. (B) База данных молекулярных сигнатур использовалась для анализа обогащения набора генов, чтобы найти избыточно представленные термины онтологии генов (GO), представляющие верхние дифференциально регулируемые гены (отсечка нескорректированного значения p p <1E-04).Анализ выявил 22 термина GO с более чем 5% перечисленных генов, дифференцированно регулируемых в каждой группе, девять из них были чрезмерно представлены в анализе как матерей, так и новорожденных (зеленый фон), пять достигли только значимости или 5% сокращения. выкл. у матерей (сине-зеленый фон) и только у восьми в неонатальном анализе (желтый фон). Термины GO были вручную сгруппированы и обозначены цветом и связаны с их дифференцированно регулируемыми генами с помощью цветных аккордов. Белые кружки представляют преобразованное нескорректированное значение p из сравнительного сравнения выбора маркеров Ro / La + и здоровых новорожденных контрольной группы, серые кружки представляют то же самое для матерей.Красная пунктирная линия обозначает границу включения для анализа обогащения, синяя линия представляет нескорректированную границу значимости p <0,05. Изображены гены, значительно дифференцированно регулируемые в любом анализе, принадлежащие к любому из изображенных терминов GO. РНК достаточного количества и качества была доступна для анти-Ro / La + матерей № 1–10, новорожденных № 1–11 и семи здоровых контрольных пар мать-новорожденный (таблица 1). HC, здоровый контроль.
Чтобы понять, какие пути представляют идентифицированные гены, рассмотрим основные дифференциально регулируемые гены (p≤0.0001), включая 238 генов из материнского анализа и 197 генов из неонатального анализа, были использованы для анализа обогащения набора генов с целью выявления избыточного представления терминов GO (рисунок 1B). Анализ выявил значительное обогащение терминов GO, преимущественно относящихся к передаче сигналов и ответам IFN, включая термины GO, представляющие вирусные ответы, как у матерей, так и у новорожденных (рисунок 1B, дополнительные онлайн-таблицы S1 и S2).
Эти результаты впервые демонстрируют, что PBMC, полученные от новорожденных, подвергшихся воздействию анти-Ro / La, имеют значительно отличающийся профиль экспрессии генов по сравнению с новорожденными, рожденными от здоровых людей из контрольной группы, с дифференциально экспрессируемыми генами, преимущественно участвующими в путях IFN, аналогично тому, что наблюдается у их анти-Ro / La положительных матерей.
Новорожденные, рожденные от нелеченных анти-Ro / La положительных матерей, но не новорожденные, рожденные от женщин, получавших иммуномодулирующие препараты, при рождении имеют высокий балл IFN Ro / La положительные матери, что согласуется с предыдущими сообщениями о наличии ИФН у пациентов с СКВ и СС (рис. 2А). Важно отметить, что экспрессия IFN-индуцированных генов в PBMC, выделенных из пуповинной крови младенцев, подвергшихся воздействию анти-Ro / La, также была увеличена по сравнению с контролем (фигура 2A).Затем мы использовали данные экспрессии IFN-индуцированных генов для расчета баллов по IFN.20. Мы наблюдали, что анти-Ro / La положительные женщины имели значительно более высокий балл IFN, чем здоровые контрольные (рис. 2B), и, что важно, их новорожденные также имели значительно более высокий балл IFN по сравнению с контрольными новорожденными (рисунок 2C), причем показатели IFN у матери и новорожденного показали сильную и значимую положительную корреляцию (рисунок 2D).
Рисунок 2Гены, регулируемые интерфероном (IFN), дифференциально экспрессируются в мононуклеарных клетках периферической крови анти-Ro / La положительных матерей, здоровых контрольных матерей и их новорожденных.(A) Экспрессия генов, присутствующих в терминах «генная онтология (GO): регуляция продукции IFN типа I» и «GO: ответ на IFN типа I», была отфильтрована для дифференциальной экспрессии (p <0,05) при сравнительном выборе маркеров. для здоровых контролей по сравнению с Ro / La положительными (Ro / La +) матерями и новорожденными. Гены и образцы визуализировали с помощью Morpheus. (B) Показатели IFN у матерей (здоровые контрольные, Ro / La + без иммуномодулирующего лечения или с иммуномодулирующим лечением. (C) Показатели IFN новорожденных (рожденных здоровыми контрольными матерями, Ro / La + без или с иммуномодулирующей терапией).(D) Показатели IFN для матерей (только не получавших лечения) и их новорожденных, показывающие значительную корреляцию между показателями IFN у матерей и их новорожденных при рождении (r = 0,87, p <0,0001). Рисунок включает данные по Ro / La + матерям № 1–10, 12–16, новорожденным № 1–16 и семи здоровым парам «мать-новорожденный» из контрольной группы (таблица 1). **** p <0,0001, *** p <0,001, ** p <0,01, * p <0,05.
Последующий анализ анти-Ro / La положительных матерей, получавших иммуномодулирующие препараты, и их новорожденных показал, что, хотя показатели IFN у матерей не отличались от показателей группы матерей, не получавших лечения, экспрессия IFN-индуцированных генов у их новорожденных был значительно ниже по сравнению с новорожденными от нелеченных матерей (рис. 2B, C).Примечательно, что не было значительных различий в оценке IFN новорожденных, рожденных от анти-Ro / La положительных матерей, получавших иммуномодулирующие препараты, и новорожденных, рожденных от здоровых контролей (рисунок 2C).
В целом, наши данные показывают, что не только матери с циркулирующими аутоантителами против Ro / La, но и их новорожденные имеют значительно более высокий балл IFN, чем контрольная группа, и что иммуномодулирующее лечение матери может снизить экспрессию IFN-регулируемых генов в плод.
Новорожденные, рожденные от анти-Ro / La положительных женщин, имеют повышенные уровни IFNα в плазме и повышенную экспрессию моноцитов SIGLEC-1 при рождении
Чтобы оценить, наблюдается ли повышенная экспрессия индуцированных IFN генов в PBMC новорожденных, рожденных с анти-Ro / La положительные матери были связаны с присутствием IFN типа I в их плазме при рождении, тест DELFIA17, который выявляет большинство подтипов IFNα, был проведен на пуповинной крови.Это выявило значительно более высокие уровни IFNα в плазме у детей, рожденных от анти-Ro / La положительных матерей, по сравнению с контрольной группой, аналогично тому, что наблюдалось у матерей (рисунок 3A).
Рисунок 3Уровни интерферона (IFN) α и активация иммунной системы у новорожденных, подвергшихся воздействию аутоантител Ro / La в утробе матери. (A) Уровни IFNα в плазме матерей и их новорожденных (Ro / La + матери № 1–11, 25, новорожденные № 1–11, 25 и 17 матерей с HC, 15 новорожденных с HC, таблица 1). (B, C) Частота моноцитов CD14 + и экспрессия SIGLEC-1 (средняя интенсивность флуоресценции; MedFI) у матерей и их новорожденных (Ro / La + матери № 17–24, новорожденные № 17–24 и 13 здоровых контролей пары мать-новорожденный, таблица 1).*** р <0,001. HC, здоровый контроль; PBMC, мононуклеарные клетки периферической крови; SIGLEC-1, Ig-подобный лектин, связывающий сиаловую кислоту 1.
При ХГВ макрофаги были идентифицированы как основной тип клеток при поражениях сердца, 23 и макрофаги CD68 + также наблюдались при поражениях кожи NLE24. Экспрессия SIGLEC-1, маркера активации моноцитов, индуцируется IFN типа I, а материнская экспрессия SIGLEC-1 на моноцитах недавно была описана как фактор риска развития аутоиммунного ХГВ.25 SIGLEC-1-положительные макрофаги также недавно были предположены, что они играют роль в воспалительном процессе ХГВ в сердце плода посредством активации IFN типа I. 25 26 Поэтому мы проанализировали экспрессию SIGLEC-1 на циркулирующих моноцитах CD14 + из спинного мозга. кровь при анти-Ro / La положительных и контрольных беременностях. Хотя частота моноцитов CD14 + не различалась между двумя группами (рис. 3B), экспрессия SIGLEC-1 была значительно увеличена у новорожденных, рожденных от анти-Ro / La положительных матерей, по сравнению с контрольной группой, что предполагает активацию моноцитов у новорожденных. с риском НКЭ (рис. 3С).
В совокупности наши данные показывают, что наличие IFN-сигнатуры у новорожденных, рожденных от анти-Ro / La-положительных матерей, сопровождается повышенными уровнями IFNα и признаками активированных моноцитов в их кровообращении, и подтверждают потенциально функционально важную роль этого типа. Система I IFN в патогенезе НЛЭ.
Продукция IFNα легко индуцируется в неонатальных клетках в ответ на неонатальную плазму от анти-Ro / La положительных беременностей
Взрослые иммунные клетки могут продуцировать IFN типа I после контакта с Ro / La-антителами в сочетании с апоптотическим / некротическим материалом, но есть ли внутри плода иммунные клетки также обладают этой неизвестной способностью.Чтобы понять, может ли циркулирующий IFNα, который мы наблюдали у новорожденных, рожденных от анти-Ro / La положительных матерей, продуцироваться иммунными клетками плода, мы культивировали PBMC из пуповинной крови с плазмой, объединенной с некротическим материалом, и измерили продукцию IFNα. В первую очередь мы использовали PBMC, выделенные из пуповинной крови новорожденных, рожденных здоровыми людьми из контрольной группы, поскольку мы предположили, что у плода не происходит предыдущей активации IFN, когда происходит воздействие Ro / La-аутоантител, но исследовали также клетки из внутриутробных анти-Ro / La- экспонировали новорожденные, а также материнские клетки для сравнения.Клетки подвергали воздействию плазмы новорожденных от анти-Ro / La-положительных матерей, плазмы новорожденных контрольной группы или анти-Ro / La-положительной материнской плазмы.
Нет клеток, продуцирующих IFNα в ответ на плазму от контрольных новорожденных. Однако PBMC как от контрольных новорожденных, так и от новорожденных, подвергшихся воздействию анти-Ro / La, легко продуцировали высокие уровни IFNα в ответ на плазму новорожденных, подвергшихся воздействию анти-Ro / La. Вырабатываемые уровни IFNα были аналогичны уровням, продуцируемым материнскими PBMC, подвергнутыми воздействию материнской анти-Ro / La-положительной плазмы (фиг. 4).
Рисунок 4Продукция интерферона (IFN) α легко индуцируется в мононуклеарных клетках периферической крови новорожденных (PBMC) в ответ на плазму от анти-Ro / La положительных беременностей. IFNα, продуцируемый PBMC, выделенным из новорожденных, подвергшихся воздействию аутоантител против Ro / La, а также матерей и культивированных в указанных дифференциальных условиях. **** p <0,0001, *** p <0,001, * p <0,05. HC, здоровый контроль.
В целом, эти данные впервые демонстрируют, что неонатальные PBMC могут продуцировать IFNα после воздействия плазмы, содержащей антитела Ro / La.
Обсуждение
В этом исследовании мы изучили активацию системы IFN типа I при аутоантител-положительных беременностях Ro / SSA и La / SSB и обнаружили, что не только матери, но и их новорожденные имеют повышенные уровни IFNα в плазме клеточная IFN-сигнатура и активированные моноциты. Мы также демонстрируем, что PBMC плода может продуцировать IFNα в ответ на Ro / La-положительную плазму, и, в частности, что иммуномодулирующее лечение матери может снизить IFN-ответ у плода.
Циркулирующий IFNα, обнаруженный нами у новорожденных, подвергшихся воздействию анти-Ro / La, может происходить либо от матери, либо вырабатываться клетками плода. В этом отчете мы впервые показываем, что иммунные клетки плода способны продуцировать IFNα в ответ на Ro / La аутоантитела-положительную плазму. Следовательно, возможно, что материнские аутоантитела к Ro / La, которые, как ранее было показано, индуцируют продукцию IFNα во взрослых PBMC и проникают через плаценту 11, 12, индуцируют продукцию IFNα фетальными клетками in vivo.Возможные источники фетального IFNα не исключают друг друга, но исследования in vitro показали, что провоспалительные цитокины, включая IFNα, не проходят через нормальную плаценту.27 28 Плацента при ранней и / или аутоиммунной беременности может по-прежнему функционально различаться, 29 потенциально позволяя передачу материнского IFN. Наше наблюдение, что новорожденные от матерей, получающих иммуномодулирующее лечение, имеют значительно более низкие баллы IFN, чем новорожденные от нелеченных матерей, хотя баллы IFN у получавших лечение матерей все еще были высокими, однако, поддерживает гипотезу о том, что по крайней мере большая часть IFN вырабатывается в плоде. .
Роль IFNα в патогенезе NLE, включая CHB, только начинает изучаться. Интересно, что недавние исследования показали, что повреждение сердечной ткани у плода может быть опосредовано действием IFN типа I на фибробласты плода.30 Эти исследования предполагают роль SIGLEC-1-положительных лейкоцитов, обнаруженных в сердцах плода, в опосредовании сердечной ткани. воспаление и фиброз. 26 Другая недавняя публикация продемонстрировала, что матери детей с ХГВ имеют значительно более высокую экспрессию SIGLEC-1 на моноцитах и повышенные уровни циркулирующего IFNα, 25 в соответствии с нашими выводами.В этом отчете мы дополнительно показываем, что повышенная экспрессия SIGLEC-1 на моноцитах CD14 + не ограничивается матерями, но также наблюдается у их новорожденных. Ранее сообщалось, что воздействие Ro / SSA и La / SSB, а также других аутоантител во время беременности влияет на развитие нервной системы как у детей с ХГВ, так и без него.31 Специфические аутоантитела против NMDA были связаны с волчанкой в ЦНС, 32 но Недавний отчет, демонстрирующий IFN-зависимую потерю синапсов и поведенческие фенотипы у мышей, склонных к волчанке, предполагает, что IFN типа I как таковой может влиять на развитие нервной системы.10 Это подчеркивает важность дальнейших исследований для понимания возможного влияния IFN типа I на NLE, а также на развитие и исход плода.
Лечение материнского гидроксихлорохина было предложено для защиты от развития ХГВ.33 34 Наше наблюдение IFN-сигнатуры у новорожденных, рожденных от нелеченных анти-Ro / La-положительных матерей, но не у новорожденных от матерей, получавших иммуномодулирующие препараты, может обеспечить молекулярную основу для такой потенциальный защитный эффект. Гидроксихлорохин проникает через плаценту и, как было показано, ингибирует передачу сигналов эндосомного толл-подобного рецептора (TLR) и, таким образом, может снижать активацию аутоантител-зависимого IFN типа I у плода.Интересно, что наши данные показывают, что иммуномодулирующее лечение может повлиять на оценку IFN плода, даже если оценка матери остается высокой, что позволяет предположить, что гидроксихлорохин и другое иммуномодулирующее лечение могут принести пользу плоду, даже если оценка IFN матери не приведена. вернуться к нормальному уровню. Примечательно, что несколько исследований показывают, что значительное число детей с ХГВ рождаются от анти-Ro / La положительных матерей без диагноза ревматизма и, следовательно, без лечения.17 35–37
Исследование ограничено тем, что не включает новорожденных с ХГВ, подвергшихся воздействию аутоантител Ro / La. Однако наша главная цель состояла в том, чтобы оценить потенциальное присутствие IFN-сигнатуры у младенцев, подвергшихся воздействию Ro / La аутоантител, и длительное лечение высокими дозами стероидов, обычно назначаемое при беременности, осложненной ХГВ, повлияет на выработку цитокинов, маскируя ХГВ плода. родственная экспрессия гена. Тем не менее, активация путей IFN типа I была продемонстрирована в клетках сердца, полученных из нескольких сердец плодов с CHB при прерывистой беременности, когда лечение не было начато, 26, 30 предполагая, что IFN типа I действительно имеет отношение к патогенезу CHB.Проспективные исследования, характеризующие материнские уровни IFN и баллы IFN на ранних стадиях анти-Ro / La положительных беременностей, будут представлять интерес для понимания их потенциальной прогностической ценности для развития ХГВ.
Таким образом, мы здесь демонстрируем, что новорожденные, рожденные от анти-Ro / La положительных матерей, имеют повышенные уровни IFNα и сигнатуру IFN в периферической крови при рождении, и что IFN типа I может продуцироваться неонатальными иммунными клетками после воздействия Ro / La плазма, содержащая аутоантитела.Наши результаты раскрывают новый молекулярный путь, посредством которого аутоантитела против Ro / La могут способствовать риску НВЭ и ХГВ. Кроме того, наши данные предполагают, что иммуномодулирующее лечение матери может предотвратить активацию системы IFN типа I у плода.
Благодарности
Мы благодарим доктора Биргитту Гуллстранд за отличную техническую помощь и родильные отделения в больнице Каролинского университета, Южной больнице, университетской больнице Дандерид, BB Sophia, университетской больнице Сконе, университетской больнице Эребру, университетской больнице Сахлгренска. , Университетскую больницу Упсалы за неоценимую поддержку при взятии проб крови.Мы благодарны д-ру Орели Амбрози, Каролинский институт, за вклад в написание статьи.
Использование интерферона бета при грудном вскармливании
- Предупреждения о грудном вскармливании
- Интерферон бета
Проверено с медицинской точки зрения Drugs.com. Последнее обновление: 22 октября 2020 г.
Уровни бета-интерферона и его влияние при грудном вскармливании
Краткое описание использования в период лактации
Уровни интерферона бета-1а в грудном молоке минимальны.Кроме того, поскольку интерферон плохо всасывается при пероральном приеме, маловероятно, что он попадет в кровоток младенца. Многие женщины кормили грудью, принимая интерферон бета-1а, при этом не сообщалось о побочных эффектах у младенцев. Центр передового опыта в области репродукции и здоровья детей при рассеянном склерозе считает интерферон бета «умеренно безопасным» для использования во время грудного вскармливания [1], группа неврологов, согласованная во Франции, пришла к выводу, что интерферон бета может использоваться во время грудного вскармливания [2], и маркировка в Европейские страны заявляют, что бета-интерферон можно использовать во время грудного вскармливания.Во время кормления грудью при использовании бета-интерферона не требуется никаких специальных мер предосторожности.
Пастеризация по держателю (62,5 ° C в течение 30 минут) снижает концентрацию эндогенного гамма-интерферона в среднем примерно на 10%. [3]
Уровни лекарств
Материнские уровни. Шесть женщин получали интерферон бета-1а (Avonex, Biogen) 30 мкг внутримышечно один раз в неделю по поводу рассеянного склероза. Образцы молока из обеих грудей были собраны после сцеживания с помощью электрического молокоотсоса: 8 раз после исходной дозы и еще 7 раз в течение первых 72 часов после введения дозы.Образцы были объединены и проанализированы на интерферон бета-1а. Около половины образцов содержали неопределяемое (<20 нг / л) количество лекарственного средства. Самые высокие концентрации были обнаружены через 1 или 4 часа после введения дозы у всех женщин. Самая высокая обнаруженная концентрация составила 171 нг / л у одной женщины. Используя это значение, авторы подсчитали, что максимальная скорректированная по весу доза, которую получит младенец, составляет 0,006% от дозы для матери. [4]
Младенческие уровни. Соответствующая опубликованная информация на дату ревизии не найдена.
Воздействие на младенцев на грудном вскармливании
Шесть женщин получали интерферон бета-1а (Avonex, Biogen) 30 мкг внутримышечно один раз в неделю от рассеянного склероза в течение нескольких месяцев или лет. Ни одна из матерей не заметила каких-либо побочных эффектов у младенцев, находящихся на грудном вскармливании. [4]
Женщина получала интерферон бета-1b (бетаферон, BayerHealthCare; дозировка не указана) от рассеянного склероза на протяжении всей беременности. Она продолжала принимать препарат, пока кормила ребенка исключительно грудью. В возрасте 5 месяцев ребенок регулярно находился под наблюдением врача, и он хорошо развивался без отклонений от нормы.[5]
Одна мать получала интерферон бета-1а от рассеянного склероза во время беременности и в послеродовом периоде. Все их дети находились на исключительно грудном вскармливании в течение 6 месяцев, и ни у одного из них не было обнаружено заметных проблем [6].
По данным, собранным из 4 стран, 17 женщин получали интерферон и 41 женщина получали глатирамер во время беременности и в послеродовом периоде для лечения рассеянного склероза. Из них 63% кормили грудью своих младенцев (степень не указана) в среднем в течение 8,8 месяцев. Не упоминалось о побочных реакциях у младенцев, находящихся на грудном вскармливании.[7]
Тридцать девять женщин с рассеянным склерозом, которые лечились интерфероном бета-1а во время грудного вскармливания, находились под наблюдением Немецкого регистра рассеянного склероза и беременностей. В период грудного вскармливания препарат вводили через день (n = 8), 3 раза в неделю (n = 15) или один раз в неделю (n = 12). Кроме того, одна женщина получала пегинтерферон бета-1а каждые 2 недели, а еще у 3 женщин частота не была известна. Одна женщина получала как интерферон бета-1а через день, так и глатирамер ежедневно.Большинство младенцев также подвергались облучению во время беременности. Младенцы находились на грудном вскармливании в среднем в течение 9,2 месяцев (от 1,6 до 28,5 месяцев) во время терапии интерфероном. Младенцы наблюдались в течение 1 года и наиболее нормально развивались; процент младенцев с задержкой в развитии, курсами антибиотиков и госпитализацией не отличался от контрольного населения Германии. Не было обнаружено никаких состояний, связанных с интерфероном бета-1a. [8] В последующем отчете о 28 младенцах, матери которых получали интерферон бета-1а, интервью проводились через 1, 3, 6 и 12 месяцев после родов.Был выявлен один случай задержки моторного развития, но авторы считают, что не было доказательств того, что воздействие лекарств во время кормления грудью приводило к каким-либо неблагоприятным исходам для новорожденных [9].
Влияние на лактацию и грудное молоко
Соответствующая опубликованная информация на дату ревизии не найдена.
Список литературы
- 1.
Бове Р., Алван С., Фридман Дж. М. и др. Ведение рассеянного склероза во время беременности и репродуктивного возраста: систематический обзор.Obstet Gynecol. 2014; 124: 1157–68. [PubMed: 25415167]
- 2.
Бодигель Э, Бенса С, Брассат Д. и др. Рассеянный склероз и беременность. Rev Neurol (Париж). 2014; 170: 247–65. [PubMed: 24684929]
- 3.
Ewaschuk JB, Unger S, O’Connor DL, et al. Влияние пастеризации на отдельные иммунные компоненты донорского грудного молока. J Perinatol. 2011; 31: 593–8. [PubMed: 21330996]
- 4.
Хейл Т.В., Сиддики А.А., Бейкер Т.В.Перенос интерферона бета-1а в грудное молоко человека. Breastfeed Med. 2012; 7: 123–5. [PubMed: 21988602]
- 5.
Rockhoff M, Hellwig K. Aktuelle Neurologie. 2012; 39 Приложение 1: S49 – S51. [Планирование семьи и интерферон (бета) -1b — клинический случай успешной гормональной стимуляции, беременности и кормления грудью с применением интерферона (бета) -1b] doi. [CrossRef]
- 6.
Hellwig K, Gold R. Глатирамера ацетат и бета-интерферон на протяжении всей беременности и в послеродовом периоде у женщин с рассеянным склерозом.J Neurol. 2011; 258: 502–3. [PubMed: 20878174]
- 7.
Fragoso YD, Boggild M, Macias-Islas MA, et al. Последствия длительного воздействия лекарств, модифицирующих болезнь, во время беременности при рассеянном склерозе. Clin Neurol Neurosurg. 2013; 115: 154–9. [PubMed: 22633835]
- 8.
Ciplea AI, Langer-Gould A, Stahl A, et al. Безопасность потенциального воздействия IFN-бета или глатирамера ацетата на грудное молоко: исходы для младенцев в течение года. Neurol Neuroimmunol Neuroinflamm.2020; 7: e757. [Бесплатная статья PMC: PMC7251509] [PubMed: 32434802]
- 9.
Ciplea A, Stahl A, Thiel S и др. Лечение рассеянного склероза в период лактации бета-интерфероном 1а или глатирамера ацетатом. Mult Scler J 2020; 26 (3 приложения): 360-1. P0507. DOI: 10.1177 / 1352458520974937. [CrossRef]
Идентификация вещества
Название вещества
Интерферон бета
Регистрационный номер CAS
145258-61-3; 145155-23-3
Класс наркотиков
Грудное вскармливание
Лактация
Иммунологические адъюванты
Модификаторы биологического ответа
Заявление об ограничении ответственности: Информация, представленная в этой базе данных, не заменяет профессионального суждения.Вам следует проконсультироваться с вашим лечащим врачом за советом по грудному вскармливанию, связанным с вашей конкретной ситуацией. Правительство США не гарантирует и не принимает на себя никаких обязательств или ответственности за точность или полноту информации на этом Сайте.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об ограничении ответственности в отношении медицинских услуг
Эффективность, простота использования и удовлетворенность
Показать оценки и обзоры для
Эффективность
Значок всплывающей подсказкиПолучивший наибольшее количество голосов положительный отзыв
1 Люди сочли этот комментарий полезным
Я очень доволен результатами.Я принимаю это лекарство более 10 лет.
Общие обзоры и рейтинги
Состояние: рассеянный склероз Эффективность Простота использования УдовлетворенностьБыл только один Avonex на 1 год. Это вызвало такую тяжелую депрессию, что я потерял работоспособность. Это также вызвало герпес. Побочный эффект, с которым мне придется жить вечно! Хотел бы я никогда его не принимать!
1 ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: Рассеянный склероз Эффективность Простота использования УдовлетворенностьЯ принимал это лечение в течение 10 лет, побочные эффекты никогда не уменьшались, усилились. Я планирую перейти на новое лечение. У меня мигрень от Avonex.
1 ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: рассеянный склероз Эффективность Простота использования УдовлетворенностьЯ очень доволен результатами.Я принимаю это лекарство более 10 лет.

 Разобраться во всех нюансах приготовления и хранения снадобья вам всегда поможет инструкция по применению, находящаяся в упаковке.
Разобраться во всех нюансах приготовления и хранения снадобья вам всегда поможет инструкция по применению, находящаяся в упаковке.
 86–87.
86–87.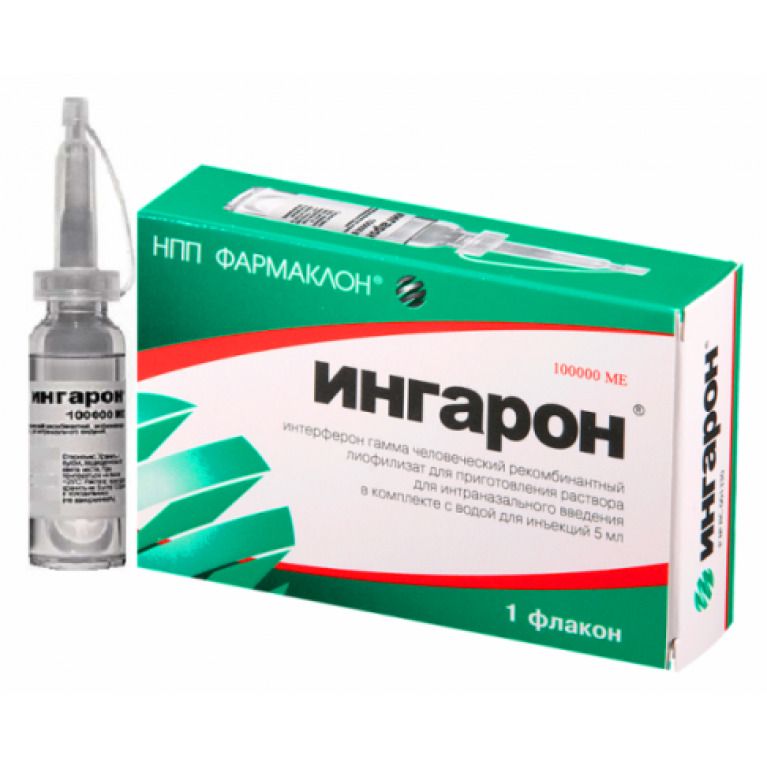

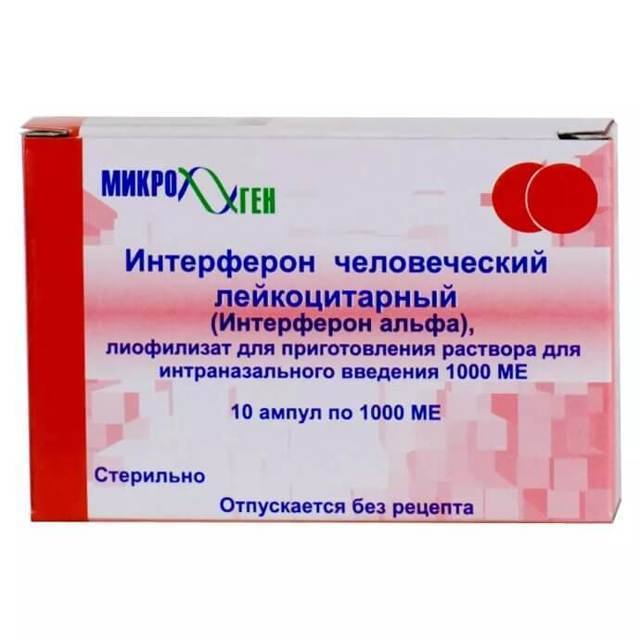 Н.И. Пирогова Ольга Васильевна Шамшева в своем докладе «Проблемы вакцинации и варианты их решения» акцентировала внимание на синергетическом подходе к вакцинации: «Сочетанное введение вакцины и препаратов с противовирусным и иммуномодулирующим действием часто болеющим детям, детям, проживающим в экологически неблагоприятных условиях и с доказанным иммунодефицитным состоянием, детям и взрослым с хронической соматической патологией позволяет снизить количество побочных эффектов, профилактировать ОРЗ, усилить антителообразование». Докладчик подчеркнула, что одним из перспективных направлений повышения эффективности вакцинации является использование различных цитокинов, в частности препаратов, содержащих интерферон альфа 2b в схеме комбинированной вакцинопрофилактики.
Н.И. Пирогова Ольга Васильевна Шамшева в своем докладе «Проблемы вакцинации и варианты их решения» акцентировала внимание на синергетическом подходе к вакцинации: «Сочетанное введение вакцины и препаратов с противовирусным и иммуномодулирующим действием часто болеющим детям, детям, проживающим в экологически неблагоприятных условиях и с доказанным иммунодефицитным состоянием, детям и взрослым с хронической соматической патологией позволяет снизить количество побочных эффектов, профилактировать ОРЗ, усилить антителообразование». Докладчик подчеркнула, что одним из перспективных направлений повышения эффективности вакцинации является использование различных цитокинов, в частности препаратов, содержащих интерферон альфа 2b в схеме комбинированной вакцинопрофилактики. Актуальность этой темы сегодня высока, потому что основными пациентами являются дети до двух лет, а четких клинических рекомендаций по лечению пока не разработано. В частности, докладчик отметила: «Для коррекции иммунологических нарушений при острых кишечных инфекциях вирусной этиологии наряду с пробиотиками представляется целесообразным использование препаратов интерферона, которые оказывают иммуномодулирующее и противовирусное действие, положительно влияют на динамику клинических проявлений».
Актуальность этой темы сегодня высока, потому что основными пациентами являются дети до двух лет, а четких клинических рекомендаций по лечению пока не разработано. В частности, докладчик отметила: «Для коррекции иммунологических нарушений при острых кишечных инфекциях вирусной этиологии наряду с пробиотиками представляется целесообразным использование препаратов интерферона, которые оказывают иммуномодулирующее и противовирусное действие, положительно влияют на динамику клинических проявлений».