|
|
Вода — Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 0,9982 г/см3[2] | ||
| Твёрдость | 1,5[6] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| • кипения | 40,656 кДж/моль[3] и 40 655,928 Дж/моль[4] | ||
| Удельная теплота испарения | 2256,2 кДж/кг[5] | ||
| Удельная теплота плавления | 332,4 кДж/кг[5] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | 231-791-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
 71 % поверхности Земли покрывает вода
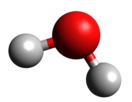
71 % поверхности Земли покрывает водаВода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[7][8].
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[9], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[10].
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[11][12]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты[13][14].
Происходит от др.-русск. вода, далее от праславянского *voda[15] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *wed-, родственно лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. get «река», фриг. βέδυ, др.-инд. udakám, uda-, udán— «вода», unátti «бить ключом», «орошать», ṓdman— «поток», алб. uj «вода»[16][17]. Также родственно русским словам ведро, выдра. В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и пр. словами, и реконструироваться как *wetV для праязыка[18].
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
- Дигидромонооксид
Физические свойства[править | править код]
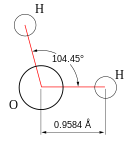
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[19]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[19]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[20].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[21]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[22][23][24]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[25]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность водыЧистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править код]
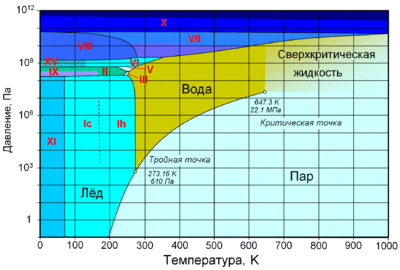
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[26]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства[править | править код]
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации[править | править код]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[20].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[20].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править код]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- в ходе реакций —
- 2h3O2→2h3O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}\uparrow }}}
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
- HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
- 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
- Восстановлением водородом оксидов металлов —
- CuO+h3→Cu+h3O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Под воздействием очень высоких температур или электрического тока (при электролизе)[27], а также под воздействием ионизирующего излучения, как установил в 1902 году[28]Фридрих Гизель[en] при исследовании водного раствора бромида радия[29], вода разлагается на молекулярный кислород и молекулярный водород:
- 2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}
Вода реагирует при комнатной температуре:
- 2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}
- со фтором и межгалоидными соединениями
- 2h3O+2F2→4HF+O2{\displaystyle {\mathsf {2H_{2}O+2F_{2}\rightarrow 4HF+O_{2}}}}
- h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах)
- 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
- 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- Al2S3+6h3O→2Al(OH)3↓+3h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- 4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}
- h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды[править | править код]
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)…ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)…ϕ1b1(2)β(2)ϕ1a1
умоляю,покажите сколько это 2\3 стакана,вечно не могу понять этого,описание не нужно.все равно не пойму
это чуть больше половины стакана (на 1 см приблизительно)
станан примерно разделить на 3 части иодну из частей оставить пустую
Стакан на 3 поделить и взять 2 части из этих 3-х. Короче, чуть больше, чем полстакана!
Примерно 170 гр.
Ето дробь. Тоесть 2 части из 3.
это примерно 66% 🙂
Возьмите стакан, приставье линейку, высоту стакана разделите на три равные части, нанесите маркером или лаком три равные деления. До среднего заполняйте. Удачи Вам!!!
плохо не учиться в школе, правда? а ведь в жизни еще много таких элементарных вещей будет встречаться. 2/3 это если разделить стакан на 3 части и заполнить 2 из них
2/3 по объему, а не по высоте, линейка на гранёном стакане не прокатит. Возьмите 3 одинаковых стакана, один заполните доверху любым веществом (например, водой) и разделите поровну с двумя другими. Общий объем в двух любых стаканах и будет 2/3 от одного стакана, можно ставить риску.
<img src=»//otvet.imgsmail.ru/download/212769562_a1f67d3589b2e555bf05af3a262e40f3_800.png» alt=»» data-lsrc=»//otvet.imgsmail.ru/download/212769562_a1f67d3589b2e555bf05af3a262e40f3_120x120.png» data-big=»1″>
Примерно разделить стакан на 3 равные между собой части, и использовать только 2!
разделить стакан на 3 равные части и взять 2
вот спасибо</a><a href=»http://orel-lada.ru» target=»_blank» > 
это нужно найти треть стакана и умножить это на 2
2/3 это если разделить стакан на 3 части и заполнить 2 из них
налить в стакан воды, и посчитать, сколько в нем чайных ложечек воды (отчерпыванием) разделить полученное число на три, затем умножить на два и налить такое количество ложечек обратно в стакан на стенке стакана зубами сделать пометку Теперь у вас есть эталон 2/3 стакана!
1/3 стакана воды, сколько это?
если стандартного то примерно — 67 мл…
200грамм делим на 3
если стандартный- то 200гр разделить на 3.
примерно 75 граммов.
Раздили на глаз стакан на 3 части. 1/3 это будет одна из этих частей.
Стакан воды примерно разделить на три части, и это будет 1/3 часть.
спасибки</a><a href=»http://ginline.ru» target=»_blank» > 
ровно столько же сколько и холодной
в уме разделите стакан на 3 части. отсчитайте ровно 1/3. ЕСЛИ СТАКАН- 150 мл. = 50 мл. ЕСЛИ СТАКАН-100 МЛ. = 33.3 ; 0.1 в остатке ЕСЛИ СТАКАН 50 мл. = 16.6666666666667
Делим стакан на три равные части и одна из них это одна третья
3/4 стакана воды это сколько ??
от стандартного стакана — 150 грамм
это целый стакан без 1/4…
примерно 170 мл
смотря какого стакана — ответ будет разным-75%.
набери 4 стакана пива. и вылей из них 3. вот и получишь ответ на свой вопрос
это надо стакан разделить на 4 части, и 3 части из этого и есть 3/4
Если «стаканом» является чашка то 150-170 мл, если же стакан стеклянный, то 190-200 мл.
Возьмите второй такой же стакан. Вылейте в него половину. Возьмите еще такой стакан. Содержимое одного из стаканов разлейте поровну. Теперь возьмите полстакана и четверть стакана. Это и будет 3/4)))
Мысленно разделите стакан на четыре части и возьмите 3 нижних части. А стаканы есть емкостью 180,200, 250 мл
это зрительно раздели стакан на 4 части и налей 3 части воды
В кулинарных рецептах когда написано «стакан» имеется в виду чаще всего 200-граммовый
вы такие тупые, откуда беретесь то???
Вода части 2 части воды это Сколько грамм? мл?
Ни сколько. Это не в граммах или мл, а в частях. Например чтоб развести уксус из уксусной кислоты до 9% нужно взять 1 часть уксусной кислоты и восемь частей воды. За одну часть можно принять чайную ложку. Тогда получится восемь чайных ложек уксуса. А можно принять 100 мл. Тогда получится 800 мл уксуса в 9%
это соотношение. относительно чего то в рецепте
если взять за 1 частьобъем в 200 мл, то 2 части- это 400 мл…
Вот насмешила! Да любая мерка! Хоть ложка чайная, хоть стакан! Даже простая чашка как мерка подойдёт! Это дело на занятиях по формированию элементарных математических представлений в детском саду проходят! Вы мимо, видимо, прошли! Или в детсад не ходили!
2 столовой ложки
1/2 стакана воды,это сколько????подскажите пожалуйста
это половина стакана
Можно даже не закусывать:))
Примерно столько :)) <img src=»//otvet.imgsmail.ru/download/9125990d44d8fb6ad9cc3f51d8e86cf9_i-1163.gif» >
Я Вам обьясню проще некуда, Ваша женская прелесть состоит из двух частей, левой и правой губы, то есть всего их две! А если их всего две, то 1/2 от вашей прелести означает одну часть из двух. Соответственно одна часть из двух имеющихся, это половина. Ну и далее по вопросу следует, что 1/2 стакана это половина стакана. Обращайтесь если что, помогу по многим вопросам.






 (
(